
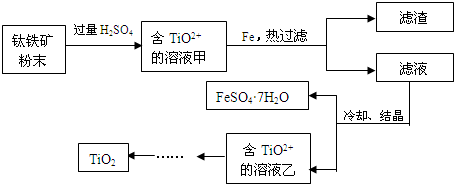
分析 (1)TiCl4水解生成TiO2•xH2O↓和HCl;氯离子和银离子反应生成白色沉淀,所以用硝酸酸化的硝酸银溶液检验氯离子;
(2)钛铁矿和过量稀硫酸混合,FeTiO3和稀硫酸反应生成Fe2+、TiO2+,氧化铁和稀硫酸反应生成Fe3+,所以溶液甲中含有Fe2+、TiO2+、Fe3+,然后向溶液中加入Fe,Fe将Fe3+氧化生成Fe2+,然后过滤得到滤渣和滤液,将滤液蒸发浓缩、冷却结晶得到绿矾和含有TiO2+溶液乙,通过一系列反应得到TiO2;
(3)先将TiO2和氯气、焦炭在高温下反应生成TiCl4,在800℃条件下,TiCl4和Mg发生置换反应生成Ti,Mg属于较活泼金属,易和空气中氧气、氮气、二氧化碳反应.
解答 解:(1)TiCl4水解生成TiO2•xH2O↓和HCl,反应方程式为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl;氯离子和银离子反应生成白色沉淀,所以用硝酸酸化的硝酸银溶液检验氯离子,其检验方法是取少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已洗净;
故答案为:TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl;取少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已洗净;
(2)氧化铁属于碱性氧化物,和稀硫酸反应生成硫酸铁和水,离子方程式为Fe2O3+6H+=2Fe3++3H2O;铁离子具有氧化性,Fe能将将Fe3+转化为Fe2+,从而除去杂质,故答案为:Fe2O3+6H+=2Fe3++3H2O;将将Fe3+转化为Fe2+;
(3)先将TiO2和氯气、焦炭在高温下反应生成TiCl4,在800℃条件下,TiCl4和Mg发生置换反应生成Ti,反应方程式为TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti,Mg、Ti属于较活泼金属,易和空气中氧气、氮气、二氧化碳反应,所以该反应需要在Ar的气氛中进行,
故答案为:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti;防止高温下Mg(Ti)与空气中O2(或CO2、N2)作用.
点评 本题考查物质分离和提纯,为高频考点,侧重考查氧化还原反应、离子检验等知识点,明确元素化合物性质是解本题关键,知道流程图中发生的反应及操作方法,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中存在:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$) | |
| D. | pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
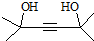 .
.
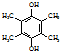
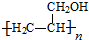 ,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于50 mL | B. | 大于50 mL | C. | 等于100 mL | D. | 大于100 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com