
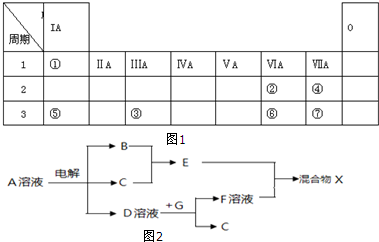
分析 根据元素所在周期表中的位置,可知①为H,②为O,③为Al,④为F,⑤为Na,⑥为S,⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)同周期自左而右非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强;
(3)图中位置由表中元素形成,电解A的溶液得到B、C、D,且B、C是单质,B为黄绿色气体,则B为Cl2、C为H2,E为HCl,单质G与D反应可以生成氢气,可推知D为NaOH,故A为NaCl,混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,则G为Al,X中含有不溶于水的物质为Al(OH)3.
解答 解:根据元素所在周期表中的位置,可知①为H,②为O,③为Al,④为F,⑤为Na,⑥为S,⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Cl>F,故答案为:Na>Cl>F;
(2)同周期自左而右非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:HClO4>H2SO4,故答案为:HClO4>H2SO4;
(3)图中位置由表中元素形成,电解A的溶液得到B、C、D,且B、C是单质,B为黄绿色气体,则B为Cl2、C为H2,E为HCl,单质G与D反应可以生成氢气,可推知D为NaOH,故A为NaCl,混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,则G为Al,X中含有不溶于水的物质为Al(OH)3.
①D溶液与G反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②检验NaCl溶液中溶质的阳离子的方法:焰色反应火焰显黄色,故答案为:焰色反应火焰显黄色;
③X中含有不溶于水的物质为Al(OH)3,它在苛性钠溶液中发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查元素周期表与元素周期律综合应用、无机物推断,难度不大,注意对元素周期律的理解掌握.


科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:选择题
X、Y、Z、M、N代表五种金属。有以下化学反应:
①水溶液中:X+Y2+=X2++Y
②Z+2H2O(冷)=Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-=M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,则这五种金属的活动性由弱到强的顺序是( )
A.M<N<Y<X<Z B.N<M<X<Y<Z
C.N<M<Y<X<Z D.X<Z<N<M<Y
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇存在的共价键总数为10 NA | |
| B. | 常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA | |
| C. | 7.2g新戊烷与异戊烷的混合物中所含极性共价键的数目为1.2NA | |
| D. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池内部电子从正极流向负极 | |
| B. | 负极电极反应式为:CH4-8e-+10OH-═CO32-+7H2O | |
| C. | 正极电极反应式为:O2+4e-═2O2- | |
| D. | 每消耗22.4 L CH4,外线路中将通过8 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4分子的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 甲醛分子的电子式: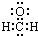 | D. | 基态硫原子的价电子排布:2s22p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内的总压不随时间变化 | |
| B. | 容器中气体的平均相对分子质量不随时间变化 | |
| C. | XY气体的物质的量分数不变 | |
| D. | X2和Y2的消耗速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气除去乙烯 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸酸化 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com