
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.006 | 0.004 | 0.004 | 0.004 |
| 0.0082 |
| 0.0022×0.001 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.01mol/L-0.003mol/L |
| 2s |


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
 A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )
A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )| A、原酸溶液的浓度c(A)=c(B) |
| B、原酸溶液的浓度c(A)>c(B) |
| C、若a=5,则A为强酸,B为弱酸 |
| D、若2<a<5,则A、B都是弱酸,酸性A<B |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
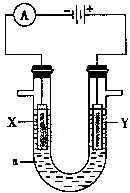 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验要求 | 证明亚硫酸钠氧化变质 | 证明某白色固体中含有NH4+ | 除去铁粉中少量铝粉 | |
| 答案 | Ⅰ | |||
| Ⅱ | . | |||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| B、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| C、醋酸钠的水解:CH3COO-+H3O+?CH3COOH+H2O |
D、苯酚钠溶液中通入CO2气体: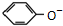 +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com