
【题目】下列说法正确的是( )
A.稀释Na2CO3溶液时,c(HCO3-)、![]() 均增大
均增大
B.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H<0,△S<0
C.用0.1molL-1CH3COOH溶液滴定0.1molL-1NaOH至中性时:c(CH3COO-)+c(CH3COOH)=c(Na+)
D.向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小
科目:高中化学 来源: 题型:
【题目】常温下,下列有关离子共存的说法中正确的是( )
A.某无色溶液中可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
B.在水电离出![]() 浓度为
浓度为![]()
![]() 的澄淸透明溶液中可能大量存在
的澄淸透明溶液中可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
C.小苏打溶液中,可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
D.使甲基橙呈红色的溶液中,可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应: 3A(g)+B(g) ![]() 2C(g)+xD(g) ,已知达到平衡时生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g) ,已知达到平衡时生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A.x=3
B.A的转化率为50%
C.平衡时B的浓度为1.5 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的95%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3
C. 明矾水解生成Al(OH)胶体,可用作净水剂
D. 室温下,SiO2(s)+3C(s)=SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下将1mol N2和2molH2的混合气体通入1L密闭容器中,在一定条件下发生反应,达到化学平衡时,测得混合气体中N2的物质的量为0.5mol。求:
(1)平衡时H2的转化率_______________。
(2)此温度下反应N2 (g) + 3H2(g)![]() 2NH3 (g)的平衡常数_______________。
2NH3 (g)的平衡常数_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B. 1 mol金刚石晶体中,平均含有2 mol C—C键
C. 水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
D. 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
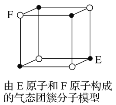
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某血液样品中钙离子的含量,可取该样品2.00mL用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用1.000×10-4molL-1酸性KMnO4标准溶液滴定,到达终点时用去20.00mL标准液。则下列说法中错误的是( )
A.用酸性KMnO4(aq)滴定H2C2O4(aq)的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
B.KMnO4标准溶液应用碱式滴定管盛装
C.滴定终点时的现象为:最后1滴标准KMnO4(aq)使锥形瓶中溶液由无色变为浅紫色,且约半分钟内不褪色
D.经计算该样品中钙离子浓度为1.000×10-4gmL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理__。
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则该温度下水的离子积常数KW=__。在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=___。
Ⅱ.工业生成尿素的原理是以NH3和CO2为原料合成尿素,反应的化学方程式为2NH3(g)+ CO2(g)![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
(1)ΔH___0(填“>”、“<”或“=”)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___。

(3)图中的B点对应的NH3的平衡转化率为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com