
| A、用石墨电极电解氯化铜溶液时,若阴极增重64 g,则阳极能产生NA个氯气分子 |
| B、25℃,pH=1的稀硫酸中含有的H+数为0.1 NA |
| C、用石墨电极电解饱和食盐水,当阴极产生2.24 L H2时,转移的电子数一定为0.2 NA |
| D、100 mL 1 mol?L-1的NH4Cl溶液中,NH4+的数目等于0.1 NA |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰水中通入过量的CO2:CO2+Ca2++2OH-=CaCO3↓+H2O |
| B、NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- |
| C、氧化铜溶于硫酸:O2-+2H+═H2O |
| D、碳酸钙溶于醋酸:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 | ||||||
| B、任何元素的原子都是由核外电子和核内中子、质子构成的 | ||||||
| C、钠原子失去一个电子后,它的电子数与氖原子相同,变成10e-微粒 | ||||||
D、
| ||||||
E、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,0.1mol/L CH3COOH中所含H+数目为0.1NA |
| B、78gNa2O2与水充分反应,转移的电子数为2NA |
| C、25℃时,1L pH=13的Ba(OH)2溶液中由水电离产生的OH-数目为0.1NA |
| D、电解精炼铜时,若电池中转移2NA个电子,则阴极质量增加64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
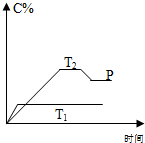 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com