
【题目】组成生命的最基本元素之一是碳,其单质及化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子价电子原子轨道表示式为________,其核外有________种空间运动状态的电子.
(2) 有机物中都含有碳原子,这和碳原子电子云的成键特点有关,试解释有机物种类繁多的原因________ 。
(3) 比较下列碳酸盐在一定温度下会发生分解的温度和对应的阳离子半径,分析其变化规律及原因_____________。
碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离了半径/pm | 66 | 99 | 112 | 135 |
(4)1828 年,德国化学家乌勒(F·Wohler)冲破了生命力学说的束缚,在实验室里将无机物氰酸铵(NH4CNO)溶液蒸发,得到了有机物尿素[CO(NH2)2]。尿素中C、N、O第一电离能大小顺序为____________。
(5) 碳的同素异形体有多种,其中一种为石墨,系平面层状结构。同一层内每个碳原子与其它三个碳原子以C -C 键相连构成平面正六边形,且层间可以滑动,它的结构如图所示。其中碳原子的杂化方式为_______,层间存在的作用力为__________。
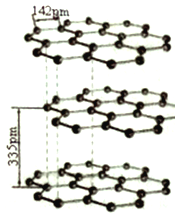
(6)石墨晶体二维结构的特殊性。
①同一层面内的平面六元并环结构(见上图)。在含lmolC原子的石墨中,有_____个平面正六边形。
②已知石墨层间距为335pm,C-C键长为142pm,其密度______g/cm3(已知:lpm=10-10cm。列出计算式即可)
【答案】 ![]() 6 碳原子间的价电子可以通过sp3 sp2 sp等形成共用电子对,构成长的碳链、碳环,以及碳碳单键、双键、三键,而且还存在同分异构现象 因为碳酸盐的分解过程实际上是晶体中阳离子结合CO32-中的氧离子,使CO32-分解为CO2的过程,所以当阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力就越强,对应的碳酸盐就越容易分解 N>O>C sp2 分子间作用力 0.5NA
6 碳原子间的价电子可以通过sp3 sp2 sp等形成共用电子对,构成长的碳链、碳环,以及碳碳单键、双键、三键,而且还存在同分异构现象 因为碳酸盐的分解过程实际上是晶体中阳离子结合CO32-中的氧离子,使CO32-分解为CO2的过程,所以当阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力就越强,对应的碳酸盐就越容易分解 N>O>C sp2 分子间作用力 0.5NA ![]()
【解析】(1)轨道表示式是用方框和箭头表明核外电子排布的式子,碳原子价电子排布式为2s22p2,根据能量最低原理、泡利不相容原理和洪特规则,其价电子原子轨道表示式为![]() ;碳原子核外有6个电子,原子核外不存在运动状态完全相同的电子,所以其核外有6种空间运动状态的电子。
;碳原子核外有6个电子,原子核外不存在运动状态完全相同的电子,所以其核外有6种空间运动状态的电子。
(2)有机物中都含有碳原子,碳原子间的价电子可以通过sp3、sp2、sp等形成共用电子对,即形成碳碳单键、碳碳双键、碳碳叁键,可以构成长的碳链、碳环,而且还存在同分异构现象,这些都是有机物种类繁多的原因。
(3)由表中数据可看出:碳酸盐中阳离子半径越小,就越容易分解,因为碳酸盐分解过程实际是晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解。
(4)同周期从左到右随着原子序数的增大第一电离能呈增大趋势,但是N元素原子的2p能级有3个电子,为半充满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C。
(5)石墨是平面层状结构,每层每个碳原子与周围的三个碳原子成σ键,键角为120°,根据价层电子对互斥理论,石墨中的碳以sp2的方式进行杂化;石墨晶体中层与层之间相隔340pm,距离较大,是以范德华力(即分子间作用力)结合起来的。
(6)①由图可得,每个碳原子被3个六元环占有,利用均摊法计算,每个六元环含有碳原子个数=![]() ×6=2,则在含lmolC原子的石墨中,有0.5NA个平面正六边形。②对于任一层石墨中的一个六元环,正六边形环的边长是142pm,将正六边形的六个顶点与正六边形的中心连线,分成6个边长为142pm的正三角形,所以正六边形的面积S=6×
×6=2,则在含lmolC原子的石墨中,有0.5NA个平面正六边形。②对于任一层石墨中的一个六元环,正六边形环的边长是142pm,将正六边形的六个顶点与正六边形的中心连线,分成6个边长为142pm的正三角形,所以正六边形的面积S=6×![]() ×142×142×sin600pm2=3×1422×sin600 pm2;石墨的层间距为335pm,可以认为一层石墨的厚度是335pm,那么一个六元环的体积V=3×1422×sin600×335 pm3=3×1422×sin600×335×10-30 cm3;又根据前面利用均摊法计算,每个六元环含有2个C原子,所以一个六元环的质量m=
×142×142×sin600pm2=3×1422×sin600 pm2;石墨的层间距为335pm,可以认为一层石墨的厚度是335pm,那么一个六元环的体积V=3×1422×sin600×335 pm3=3×1422×sin600×335×10-30 cm3;又根据前面利用均摊法计算,每个六元环含有2个C原子,所以一个六元环的质量m=![]() =
=![]() g,因此,石墨的密度ρ=m/V=
g,因此,石墨的密度ρ=m/V=![]() g÷(3×1422×sin600×335×10-30) cm3=
g÷(3×1422×sin600×335×10-30) cm3=![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】已知1molSiO2含有4mol Si—O。有关键能数据如表,晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)=SiO2(s);ΔH=-989.2kJ·mol-1,则表中x的值为
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
A. 460 B. 920 C. 1165.2 D. 423.3
查看答案和解析>>
科目:高中化学 来源: 题型:
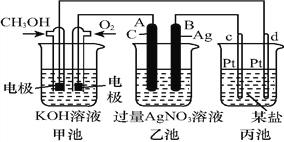
【题目】如图是一个化学过程的示意图:
请回答:
(1)图中甲池是______装置,其中OH-移向_________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH电极的电极反应式:_______________________________。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为_____极(填“A”或“B”),
并写出此电极的电极反应式:______________________。
(4)乙池中反应的离子方程式为________________________。
(5)当乙池中B(Ag)极质量增加5.40 g时,乙池c(H+)是_______(若乙池中溶液为500 mL);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是_________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关pH变化的判断中,正确的是( )
A. 随温度的升高,纯水的Kw减小
B. 随温度的升高,纯水的pH增大
C. 新制氯水经光照一段时间后,pH减小
D. 氢氧化钠溶液久置于空气中,pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。已知碱石灰的成分是氢氧化钠和氧化钙的混合物;炭与水蒸气在高温条件下发生以下反应:C + H2O(g)![]() CO + H2。回答下列问题:
CO + H2。回答下列问题:
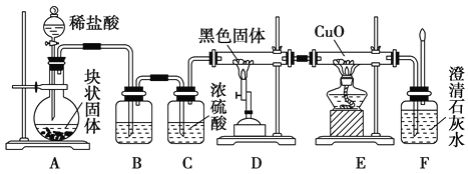
(1)写出装置A中发生反应的离子方程式____________________。
(2)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:____________。
(3)装置D中黑色固体为___________ (填名称)。
(4)按照如图装置进行实验时,首先进行的操作是___________________________________ 。
(5)根据实验中的____________________________现象,可证明CO具有还原性。
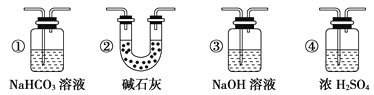
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置____与____之间连接下图中的____________________装置(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g 时,隔板处于如图位置(保持温度不变),下列说法正确的是

A. 右边CO与CO2分子数之比为1:3
B. 右侧CO的质量为14g
C. 右侧气体密度是相同条件下氧气密度的2倍
D. 若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为5: 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用0.1000 mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
填空完成问题:
(1)该滴定实验所需的玻璃仪器有______________。(填字母)
A.酸式滴定管B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台F.滴定管夹G.烧杯H.白纸 I.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________________________________。
(3)滴定终点的现象为___________________________________。
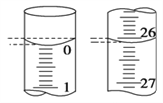
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)甲基的电子式___________。
(2)写出由丙烯制备聚丙烯的化学反应方程式_______________________。
(3)反式2 -丁烯的结构简式______________________________
(4)与H2加成生成2,5 - 二甲基己烷的炔烃的系统命名___________________________
(5)![]() 的系统命名_____________________________________。
的系统命名_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com