
【题目】将3mol A与3mol B混合于3L的密闭容器中,发生如下反应:2A(g)+3B(g)![]() 2C(g)+nD(g),2s后达平衡A的转化率为50%,测得v(D)=0.25molL-1s-1,下列推断正确的是( )
2C(g)+nD(g),2s后达平衡A的转化率为50%,测得v(D)=0.25molL-1s-1,下列推断正确的是( )
A.v(B)=0.25molL-1s-1B.C的体积分数为30%
C.B的转化率为25%D.n=2
【答案】D
【解析】
将3mol A与3mol B混合于3L的密闭容器中,2s后达平衡A的转化率为50%,则转化的A为3mol×50%=1.5mol,则:
2A(g)+3B(g)![]() 2C(g)+nD(g)
2C(g)+nD(g)
起始量(mol):3 3 0 0
转化量(mol):1.5 2.25 1.5 0.75n
平衡量(mol):1.5 0.75 1.5 0.75n
A.v(B)=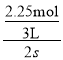 =0.375mol/(L·s),故A错误;
=0.375mol/(L·s),故A错误;
B.v(D)=0.25molL-1s-1,则0.75n mol=v(D)=0.25molL-1s-1×2s×3L,解得n=2,C的体积分数=![]() =28.6%,故B错误;
=28.6%,故B错误;
C.B的转化率=![]() ×100%=75%,故C错误;
×100%=75%,故C错误;
D.v(D)=0.25molL-1s-1,则0.75n mol=v(D)=0.25molL-1s-1×2s×3L,解得n=2,故D正确;
故答案为D。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】某固体混合物X,含有FeSO4、Fe(NO3)3、Al(NO3)3、NH4Cl、 Na2CO3 中的几种,进行如下实验:
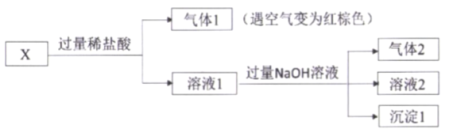
下列说法不正确的是
A.混合物X中必定含有NH4Cl、FeSO4,不含Na2CO3
B.灼烧沉淀1,可以得到红棕色物质
C.将足量的气体2通入溶液1中,将出现沉淀
D.往溶液2中通入足量的CO2,若没有出现沉淀,说明X中不含Al(NO3)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素(CO(NH2)2·H2O2)是过氧化氢水溶液与尿素的加和物,兼有尿素和过氧化氢的性质,是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。某化学小组同学用低浓度的双氧水和饱和尿素[CO(NH2)2]溶液在30℃条件下用右图装置合成过氧化尿素。请回答下列问题:
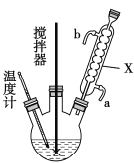
(1)仪器X的名称是______________;
(2)制备过氧化尿素的化学方程式为_______________________,反应时采取的受热方式为_____________;
(3)搅拌器不能选择铁质材料的原因是______________________
(4)过氧化尿素中活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品8.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL6mol·L-1H2SO4,然后用0.2000mol·L-1KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液与尿素不反应)。三次滴定平均消耗KMnO4溶液20.000mL:
①请完善滴定时反应的离子方程式:__MnO![]() +___H2O2+______==_______________
+___H2O2+______==_______________
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量_______(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量_______(填“合格”或“不合格”),活性氧的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同温同压下,H2 (g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件下的ΔH相同
2HCl(g)在光照和点燃条件下的ΔH相同
B. 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
C. 已知:①2H2(g) +O2(g)![]() 2H2O(g)ΔH=-a kJ·mol-1,②2H2(g)+O2 (g)
2H2O(g)ΔH=-a kJ·mol-1,②2H2(g)+O2 (g)![]() 2H2O(l)ΔH=-b kJ·mol-1,则a>b
2H2O(l)ΔH=-b kJ·mol-1,则a>b
D. 已知:①C(s,石墨)+O2 (g)![]() CO2(g)ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)
CO2(g)ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)![]() CO2 (g)ΔH=-395.0 kJ·mol-1,则C(s,石墨)
CO2 (g)ΔH=-395.0 kJ·mol-1,则C(s,石墨)![]() C(s,金刚石)ΔH= -1.5 kJ·mol-1
C(s,金刚石)ΔH= -1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如下:
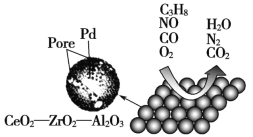
(1)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是_______________。
(2)图中互为等电子体的两种气体分子是_____________。
(3)C3H8中所有碳原子的杂化方式是___________。
(4)图中属于非极性的气体分子是_______________________。
Fe、Mn元素的部分电离能数据列于下表中
元素 | Fe | Mn | |
电离能(kJ·mol-1) | I1 | 759 | 717 |
I2 | 1561 | 1509 | |
I3 | 2957 | 3248 | |
(5)从上表两元素部分电离能数据比较的可知,气态Mn2+再失去一下电子比气态Fe2+再夫去一个电子难,原因是_____________。
(6)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,镍原子在基态时核外电子排式为_____________,[Ni(CO)4]的配体是_________,配位原子是__________。
(7)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图所示,则与每个Sr2+紧邻的O2-有______个。
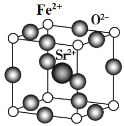
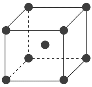
(8)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为______________g·cm-3(用来a、b、NA表示计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用。下表(元素周期表前三周期的一部分)列出了①~⑦七种元素在周期表中的位置。
① | ② | ③ | |||
④ | ⑤ | ⑥ | ⑦ |
请回答:
(1)②所代表元素的名称为______
(2)七种元素中,非金属性最强的元素是______(填元素符号),最高价氧化物的水化物酸性最强的是_______(填化学式),最高正化合价与最低负化合价的代数和为4的元素是_______(填元素符号)。
(3)②、④、⑥所对应元素中原子半径最小的是______(填元素符号),简单离子半径最大的是______(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中山大学化学科研团队首次将CsPbBr3纳米晶锚定在氨基化RGO包覆的α—Fe2O3(α—Fe2O3/Amine—RGO/CsPbBr3),构筑Z—Scheme异质结光催化剂,可有效降低电荷复合,促进电荷分离,从而提升光催化性能。光催化还原CO2和氧化H2O的反应路径如图。下列说法正确的是( )
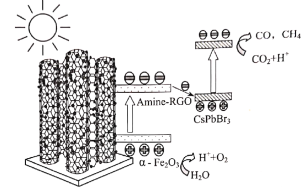
A.该路径能量转化形式为电能→化学能
B.该光催化转化反应可以阻止温室效应
C.“CsPbBr3纳米晶”表面发生了还原反应
D.该催化转化的总反应涉及到非极性共价键、极性共价键的断裂和形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分![]() )提取
)提取![]() 的一种工艺流程如下:
的一种工艺流程如下:
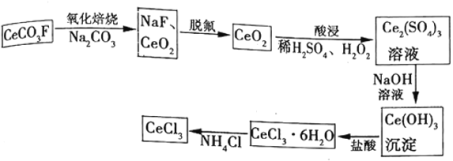
请回答下列问题:
(1)脱氟过程的实验操作是________,酸浸过程中加入![]() 的作用是________。
的作用是________。
(2)常温下,若溶液中的![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() 为________(己知
为________(己知![]() )。
)。
(3)准确称取![]() 样品置于锥形瓶中,加入适量过硫酸铵
样品置于锥形瓶中,加入适量过硫酸铵![]() 溶液将
溶液将![]() 氧化为
氧化为![]() ,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(己知:
,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(己知:![]() )
)
①已知:过二硫化酸的结构式为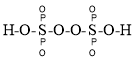 ,其中
,其中![]() 元素的化合价为________。
元素的化合价为________。
②该样品中![]() 的质量分数为________(精确到
的质量分数为________(精确到![]() )。
)。
③若使用久置的![]() 标准溶液进行滴定,测得该
标准溶液进行滴定,测得该![]() 样品的质量分数将________(填“偏大”“偏小”或“无影响”)。
样品的质量分数将________(填“偏大”“偏小”或“无影响”)。
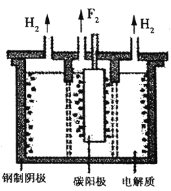
(4)脱氟过程中产生的![]() 因活性弱于熔融的氟氢化钾
因活性弱于熔融的氟氢化钾![]() ,故现代工业以电解熔融的氟氢化钾和氟化氢
,故现代工业以电解熔融的氟氢化钾和氟化氢![]() 混合物制备氟单质,电原理为
混合物制备氟单质,电原理为![]() 装置如图所示。已知
装置如图所示。已知![]() 是一种酸式盐,则阴极上发生的电极反应式为________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
是一种酸式盐,则阴极上发生的电极反应式为________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)![]() 2CO2(g)+S(s)
2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,若升高温度,CO体积分数增大,则该反应的△H>0
D. 其他条件不变,增大压强,该反应平衡常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com