
【题目】某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl﹣四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体. 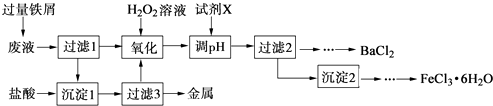
(1)沉淀1中含有的金属单质是 .
(2)氧化时加入H2O2溶液发生反应的离子方程式为 .
(3)下列物质中,可以作为试剂X的是 (填字母).
A.BaCl2
B.BaCO3
C.NaOH
D.Ba(OH)2
(4)检验沉淀2洗涤是否完全的方法是 .
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 .
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为、冷却结晶、、洗涤、干燥.
【答案】
(1)铜、铁
(2)2Fe2++2H++H2O2=2Fe3++2H2O
(3)BD
(4)取最后一次洗涤液少许,滴入1~2滴硫酸钠溶液,若不出现白色浑浊,表明已洗涤完全.(或取最后一次洗涤液少许,滴入1~2滴硝酸银溶液,若不出现白色浑浊,表明已洗涤完全)
(5)抑制Fe3+水解
(6)蒸发浓缩;过滤
【解析】解:加入的过量的铁屑,由于铁的化学性质比铜活泼,因此可以把金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在过滤得到的沉淀1中含有的金属单质铜过量的铁;滤液含有二价铁离子、钡离子、氯离子,加双氧水将二价铁氧化成三价铁离子,再加碱调节PH值使三价铁离子转变成氢氧化铁沉淀而除去,所以沉淀2为氢氧化铁,进一步转化成氯化铁晶体,而滤液2则只剩氯化钡溶液,经过蒸发浓缩,冷却结晶、过滤、洗涤、干燥进一步转化成氯化钡固体;(1)废液中含有Fe3+、Cu2+两种金属离子,加入过量的铁粉后,铜离子被还原成金属铜,所以在第①得到的沉淀中含有金属铜和过量的铁,
故答案为:铜、铁;(2)根据以上分析,氧化时加入H2O2溶液与二价铁离子发生氧化还原反应,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;(3)根据以上分析,加试剂X调节PH值使三价铁离子转变成氢氧化铁沉淀而不能引入新的杂质,所以选BD,故选:BD;(4)取最后一次洗涤液少许,滴入1~2滴硫酸钠溶液,若不出现白色浑浊,表明已洗涤完全.(或取最后一次洗涤液少许,滴入1~2滴硝酸银溶液,若不出现白色浑浊,表明已洗涤完全.),故答案为:取最后一次洗涤液少许,滴入1~2滴硫酸钠溶液,若不出现白色浑浊,表明已洗涤完全.(或取最后一次洗涤液少许,滴入1~2滴硝酸银溶液,若不出现白色浑浊,表明已洗涤完全.);(5)因为氯化铁蒸发时水解生成易挥发的氯化氢,所以制备氯化铁晶体过程中需保持盐酸过量,抑制Fe3+水解,故答案为:抑制Fe3+水解;(6)根据以上分析,氯化钡溶液,经过蒸发浓缩,冷却结晶、过滤、洗涤、干燥进一步转化成氯化钡固体;
故答案为:蒸发浓缩;过滤.
加入的过量的铁屑,由于铁的化学性质比铜活泼,因此可以把金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在过滤得到的沉淀1中含有的金属单质铜过量的铁;滤液含有二价铁离子、钡离子、氯离子,加双氧水将二价铁氧化成三价铁离子,再加碱调节pH值使三价铁离子转变成氢氧化铁沉淀而除去,所以沉淀2为氢氧化铁,进一步转化成氯化铁晶体,而滤液2则只剩氯化钡溶液,经过蒸发浓缩,冷却结晶、过滤、洗涤、干燥进一步转化成氯化钡固体,以此解答;(1)加入的过量的铁屑,由于铁的化学性质比铜活泼,因此可以把金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在过滤得到的沉淀1中含有的金属单质铜过量的铁;(2)氧化时加入H2O2溶液与二价铁离子发生氧化还原反应,据此写出反应的离子方程式;(3)根据加试剂X调节pH值使三价铁离子转变成氢氧化铁沉淀进行解答;(4)检验是否洗涤完全,可取最后一次滤液,检验溶液中是否含有钡离子;(5)因为氯化铁蒸发时水解生成易挥发的氯化氢,所以制备氯化铁晶体过程中需保持盐酸过量,抑制Fe3+水解;(6)根据以上分析解答.


科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( ) 
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.常温下氧化性:F2<Cl2<Br2<I2
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s)+Cl2(g)═MgCl2(s)+Br2(g),△H=﹣117kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为二氧化锰的有关转化关系图,有关说法中不正确的是()

A. 反应①—⑥均属于氧化还原反应
B. 反应②中Cl2既是氧化剂又是还原剂
C. 反应①中氧化剂与还原剂的物质的量之比为1∶4
D. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中不正确的是( )
A.丁达尔现象可用来区别胶体与溶液
B.胶体能透过半透膜
C.胶体的性质主要有:丁达尔现象、电泳、聚沉
D.溶液、胶体、浊液的根本区别是分散质微粒直径的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的价层电子排布图为_______________________。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C________(填“>”或“<”,下同)B;第一电离能:N________O,原因是____________________________________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_________形,其中硫原子采用_________杂化,写出SO42-的一种等电子体的化学式:____________________________。
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图1所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围________个O2-相紧邻。

(5)铁晶胞的结构如图2所示,如果晶胞边长为a,铁原子半径为r,则该晶体中铁原子的空间利用率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2﹣二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用图9所示装置制备1,2﹣二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水).请填写下列空白:
(1)烧瓶a要求温度迅速升高到170℃发生反应,写出该反应的化学方程式;该反应类型为 .
(2)写出制备1,2﹣二溴乙烷的化学方程式 .
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象 .
(4)容器c中NaOH溶液的作用是;e装置内NaOH溶液的作用是 .
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(至少2点) . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯(Pd)元素的原子序数为46,下列叙述错误的是( )
A. ![]() Pd和
Pd和 ![]() Pd互为同位素 B. Pd核外有46个电子
Pd互为同位素 B. Pd核外有46个电子
C. Pd核内有46个质子 D. ![]() Pd的原子核内有46个中子
Pd的原子核内有46个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是____________,电解质溶液是_____________。
(2)Y电极发生的电极反应为______________________________。
(3)若开始时X、Y为质量相等的电极,当两极质量差为14克时,转移的电子数为_______。
B.燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内部的新型发电装置,是一种具有应用前景的绿色电源。下图为碱性甲烷燃料电池原理示意图:

总反应:CH4 + 2O2+ 2OH-=CO2-3 + 3H2O
正极:4H2O + 2O2 + 8e- = 8OH-
按照此图的提示回答下列问题:
(1)该燃料电池的负极是______(填“a”或“b”),b电极发生_______反应(填氧化或还原)。
(2)在正极附近溶液的碱性________(填“增强”或“减弱”)。
(3)a电极的电极方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com