
 .
. 分析 (1)写出C3H6O2的同分异构体,判断分别有几种不同的氢原子;
(2)CH3CH=CHCl存在顺反异构.
解答 解:(1)C3H6O2的同分异构体有CH3CH2COOH、HCOOCH2CH3、CH3COOCH3、CH3COCH2OH、CH3CHOHCHO 不同环境下的氢原子种数分别是3、3、2、3、3,有几种不同环境的氢原子就有几种不同峰值,故答案为:CH3COOCH3;CH3CH2COOH 或 HCOOCH2CH3 或 CH3COCH2OH;
(2)CH3CH=CHCl存在顺反异构,每种结构中存在3种不同环境下的氢原子,得到氢原子给出的信号峰6种:由此可推断该有机物一定存在2种不同结构,结构式为: ,
,
故答案为: .
.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查同分异构体和同分异构现象,题目难度不大,注意第二题中顺反异构的现象,同时注意培养分析材料的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
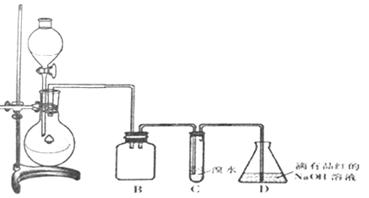
| 实验序号 | 实验操作 | 现象 | 可能的情况 |
| ① | 滴加少量淀粉-KI溶液,振荡 | III | |
| ② | 滴加少量溴水,振荡 | II | |
| ③ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
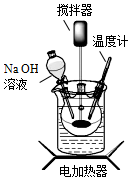 超细Fe3O4粉体可制成磁流体,一种制备超细Fe3O4粉体的实验步骤如下:
超细Fe3O4粉体可制成磁流体,一种制备超细Fe3O4粉体的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.除去粗食盐水中的泥沙 | B.配制100 mL 1.00 mol/L NaCl溶液 | C.排空气法收集氨气 | D.用自来水制取蒸馏水 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化只体现为热量的形式 | |
| B. | 铝与氧化铁反应既是氧化还原反应,又是吸热反应[ | |
| C. | 甲烷燃烧反应过程中,旧键断裂吸收的能量小于新键形成释放的能量 | |
| D. | 外界条件相同时,放热反应的速率一定大于吸热反应的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热煮沸的主要目的是除去溶液中溶解的氯气 | |
| B. | 稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管 | |
| C. | 滴定过程中可用KSCN溶液作指示剂 | |
| D. | 铁矿石中铁的质量分数为70% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为Fe,则丁可能是Cl2 | B. | 若甲为焦炭,则丁可能是O2 | ||
| C. | 若甲为SO2,则丁可能是氨水 | D. | 若甲为NaOH 溶液,则丁可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
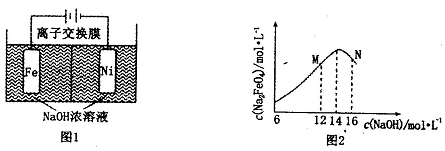
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com