
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
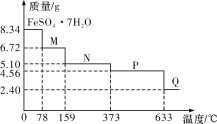
A.温度为78 ℃时固体物质M的化学式为FeSO4·5H2O
B.温度为159 ℃时固体N的化学式为FeSO4·2H2O
C.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时只得到一种无色气体生成
D.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
【答案】D
【解析】
8.34 g FeSO4·7H2O样品的物质的量为![]() =0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如果晶体失去全部结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,以此分析。
=0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如果晶体失去全部结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,以此分析。
A.温度为78℃时,固体质量为6.72g,其中m(FeSO4)= 0.03mol×152g/mol=4.56g,m(H2O)=6.72g-4.56g=2.16g,n(H2O)=![]() =0.12mol,n(H2O):n(FeSO4)=0.12mol:0.03mol=4:1,则M的化学式为FeSO4·4H2O,故A错误;
=0.12mol,n(H2O):n(FeSO4)=0.12mol:0.03mol=4:1,则M的化学式为FeSO4·4H2O,故A错误;
B.温度为159 ℃时,固体N的质量为5.10g,其中m(FeSO4)= 0.03mol×152g/mol=4.56g,m(H2O)=5.10g-4.56g=0.54g,n(H2O)=![]() =0.03mol,n(H2O):n(FeSO4)=0.03mol:0.03mol=1:1,则N的化学式为FeSO4·H2O,故B错误;
=0.03mol,n(H2O):n(FeSO4)=0.03mol:0.03mol=1:1,则N的化学式为FeSO4·H2O,故B错误;
C.加热至633℃时,固体质量为2.40g,其中n(Fe)= n(FeSO4·7H2O)=0.03mol,m(Fe)= 0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=![]() =0.045mol,n(Fe):n(O)=0.03mol:0.045mol=2:3,所以固体Q的化学式为Fe2O3,则由P的得到Q的化学方程式为2FeSO4
=0.045mol,n(Fe):n(O)=0.03mol:0.045mol=2:3,所以固体Q的化学式为Fe2O3,则由P的得到Q的化学方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑,得到2种无色气体,故C错误;
Fe2O3+SO2↑+SO3↑,得到2种无色气体,故C错误;
D. 根据以上分析,N为FeSO4·H2O,P为FeSO4,在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O,故D正确。
FeSO4+H2O,故D正确。
答案选D。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】通常状况下,![]() 、
、![]() 和
和![]() 是三种气态单质。
是三种气态单质。![]() 的组成元素是第3周期原子半径最小的元素(稀有气体元素除外);
的组成元素是第3周期原子半径最小的元素(稀有气体元素除外);![]() 和
和![]() 均由元素
均由元素![]() 组成,
组成,![]() 能氧化
能氧化![]() ,反应的离子方程式为
,反应的离子方程式为 。
。
(1)写出物质的分子式:![]() ______,
______,![]() ______,
______,![]() ______。
______。
(2)![]() 与
与![]() 的关系是______(填序号)。
的关系是______(填序号)。
a.互为同位素 b.属于同一物质
c.互为同素异形体 d.互为同分异构体
(3)导致大气中![]() 减少的主要物质是______。
减少的主要物质是______。
(4)将![]() 和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是________________________。
和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是________________________。
(5)举例说明![]() 的氧化性比硫单质的氧化性强:________________________(用化学方程式表示)。
的氧化性比硫单质的氧化性强:________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D、E 都是周期表中前四周期的元素,且原子序数依次增大,其中 A 原子核外 有三个未成对电子;A 与 B 可形成离子化合物 B3A2;C 元素是地壳中含量最高的金属元素;D 原 子核外的 M 层中有两对成对电子;E 原子核外最外层只有 1 个电子,其余各层电子均充满。以下 有关说法正确的是
A.A 离子半径小于 B 离子半径
B.B 和 C 的氯化物晶体类型相同
C.C 和 D 形成的二元化合物不能通过复分解反应得到
D.E 在周期表中位于第四周期 s 区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态 K 原子中,核外电子占据的最高能层的符号是_____,占据该能层电子的电子云轮廓图形状为_____。K 和 Cr 属于同一周期,且核外最外层电子构型相同,但金属 K 的熔 点、沸点等都比金属 Cr 低,原因是_____。
(2)X 射线衍射测定等发现,I3AsF6 中存在 I3+ 离子。I3+ 离子的几何构型为____________,中心原子的杂化类型为_______________ 。
(3)KIO3 晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结 构,边长为 a=0.446nm,晶胞中 K、I、O 分别处于顶角、体心、面心位置, 如图所示。K 与 O 间的最短距离为_____nm,与 K 紧邻的 O 个数为_____。
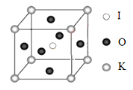
(4)在 KIO3 晶胞结构的另一种表示中,I 处于各顶角位置,则 K 处于_____________位置,O 处于_____位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用惰性电极电解200 mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)。
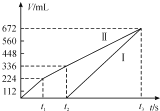
(1)曲线___(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。
(2)NaCl的物质的量浓度为___,CuSO4的物质的量浓度为___。
(3)t2时所得溶液的pH为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
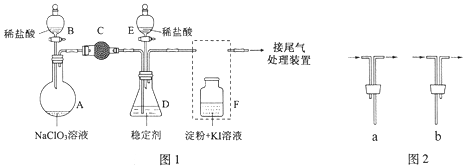
(1)仪器D的名称是 。安装F中导管时,应选用图2中的 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是__________________(用离子方程式表示)。
为将碱洗后槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为________________________________________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______________________________________________________________。
(3)利用如图装置,可以模拟铁的电化学防护。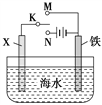
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(1)在原子经济学原则引导下,化学家用CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式___。
(2)以甲醇做燃料的电池,如图所示,其负极是___(填a或b),负极的反应式为___,正极的反应式为___。该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。

(1)B装置的作用是_________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______气体产生,写出D中发生反应的离子方程式________。
(3)A中固体分解后产生NH3,写出其两种用途_________。
(4)用实验的方法验证C溶液含有NH4+:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com