


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
| c3(C) |
| c2(A)?c(B) |
| c3(C) |
| c2(A)?c(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 1+ab |
| 1 |
| 1+ab |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 4 |
| 7 |
| 25 |
| 50-w |
| 25 |
| 50-w |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 6 |
| 5 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某化学兴趣小组在做《浓度对化学反应速率的影响》实验时发现,草酸溶液与高锰酸钾溶液反应时,溶液褪色先慢后快。为了探究此反应速率由小变大的原因,甲同学做了如下实验。
(1)0.10mol/L H2C2O4溶液的配制:
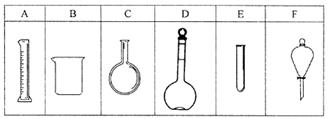
实验室欲配制80mL 0.10mol/L H2C2O4 溶液,需要称取草酸晶体(H2C2O4·2H2O g(精确到0.1g);实验中需要用到的玻璃仪器除了玻璃棒、胶头滴管、量筒外还有: 。(填代号)
(2)反应速率变化的探究
| 1号试管 | 2号试管 | |
| 所加试剂 | 2mL0.10mol/L H2C2O4 溶液, 几滴稀硫酸,4mL0.010mol/L 的KMnO4溶液 | 2mL0.10mol/L H2C2O4 溶液,几 滴稀硫酸,4mL0.010mol/L的 KMnO4溶液,少量MnSO4固体。 |
| 褪色时间 | 31秒 | 4秒 |
①H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为 。
②甲同学能够得出结论 。
(3)在一定条件下,容积为100 L密闭容器中发生反应:CH4(g)+H20(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
 ΔH>0,将1.O molCH4和2.O mol H 20(g)通入该密闭容器,10 min时有O.1 mol CO生成,则10 min内该反应的平均速率ν(H2) 。
ΔH>0,将1.O molCH4和2.O mol H 20(g)通入该密闭容器,10 min时有O.1 mol CO生成,则10 min内该反应的平均速率ν(H2) 。
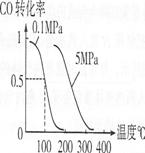
(4)在压强为O.1 MPa条件下,容积为V L某密闭容器中amol CO与2amol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
①该反应的AH O(填“<”、“>”或“=”)。
②100℃时该反应的平衡常数K (用含n、V的代数式表示)。
③在其它条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”),平衡常数 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com