
| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |
| 1000×1.84g/cm3×98% |
| 98g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、利用醋酸溶解含碳酸钙的水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、用铜为电极电解饱和食盐水:2Cl-+2H2O═Cl2↑+H2↑+2OH- |
| C、在明矾溶液中滴加过量氨水:Al3++4NH3?H2O=AlO2+4NH4++2H2O |
| D、在小苏打溶液中加少量 Ba(OH)2 溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
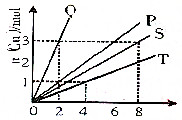 铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应:
铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(H+)>c(Na+ )>c(OH-) |
| B、c(Na+ )>c(OH-)>c(CH3COO-)>c(H+ ) |
| C、c(OH-)>c(Na+ )>c(H+ )>c(CH3COO-) |
| D、c(Na+ )>c(CH3COO-)>c(OH-)>c(H+ ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) |
| B、若用50 mL 0.55 mol?L-1的氢氧化钠溶液,分别与50 mL 0.50 mol?L-1的盐酸和50 mL0.50mol?L-1硫酸充分反应,两反应的中和热不相等 |
| C、0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2 溶液混合后,溶液的pH=1 |
| D、0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下pH=7的溶液中:Fe3+、Na+、Cl-、SCN- |
| B、常温下c(OH-)/c(H+)=1014的溶液中:K+、Mg2+、Cl-、Br- |
| C、含有大量HCO3-的澄清透明溶液中:K+、C6H5O-、Cl-、Na+ |
| D、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com