
【题目】某无色溶液中含有:①Na+、②Ba2+、③Cl-、④Br-、⑤SO![]() 、⑥SO
、⑥SO![]() 中的一种或几种,依次进行下列实验,且每步所加的试剂均过量,观察到的现象如下表所示。
中的一种或几种,依次进行下列实验,且每步所加的试剂均过量,观察到的现象如下表所示。
步骤 | 操 作 | 现 象 |
① | 用pH试纸检验 | 溶液的pH大于7 |
② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
下列实验结论正确的是( )
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑤
C.可能含有的离子是①②⑥
D.不能确定的离子是①③⑥
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】洪涝灾害后的灾民用下列步骤将河水转化为可饮用水,以下处理过程顺序合理的是 ①化学沉降(用明矾) ②消毒杀菌(用漂白粉) ③自然沉降 ④加热煮沸
A.③②①④ B.③①②④ C.③①④② D.①③④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某次采集酸雨样品,每隔一段时间测定一次pH,得到数据如下:
时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)放置时,雨水样品酸性_______________(填“增强”、“减弱”或“不变”)。
酸性变化的原因_________________________________(用化学方程式表示)。
II.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(2) 写出一氧化碳与一氧化氮反应的化学方程式:__________________________。
(3) 在“催化转化器”转化后的气体中有CO2、SO2,下列不能鉴别这两种气体的是(____)
A.KMnO4溶液 B.石灰水 C.BaCl2溶液 D.品红溶液
(4) 有效减少城市污染的方法可以有____________
A. 开发氢能源 B. 使用电动车 C. 植树造林 D. 戴上呼吸面具
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应为


(1)1 mol M完全燃烧需要________ mol O2。
(2)有机物N不能发生的反应为________(填字母序号)。
A.氧化反应
B.取代反应
C.消去反应
D.还原反应
E.加成反应
(3)M有多种同分异构体,其中能使FeCl3溶液显紫色、苯环上只有两个取代基、无环物质的同分异构体有________种。
(4)物质N与H2反应生成的P(结构简式为 )发生缩聚反应产物的结构简式为________________;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为______________________________。
)发生缩聚反应产物的结构简式为________________;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为______________________________。
(5)有机物Ⅰ、Ⅱ、Ⅲ的转化关系为Ⅰ Ⅱ
Ⅱ
有机物Ⅱ的结构简式为______________;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)![]() 2HF(g);△H= -270kJ/mol,下列说法正确的是
2HF(g);△H= -270kJ/mol,下列说法正确的是
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是( )

A.用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.按装置②所示的气流方向可用于收集H2、NH3等
C.用图③所示装置,分离CCl4萃取I2水后的有机层和水层
D.用图④所示装置,可以证明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
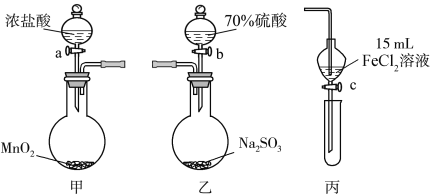
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeCl2溶液变黄时,停止加热。
3.打开活塞c,使约2 mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
5.更新丙中试管,打开活塞c,使约2 mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为_____________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_________________________。
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
Ⅰ | 既有Fe3+又有Fe2+ | 有SO |
Ⅱ | 有Fe3+无Fe2+ | 有SO |
Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
上述实验结果一定能够证明氧化性Cl2>Fe3+>SO2的是________(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
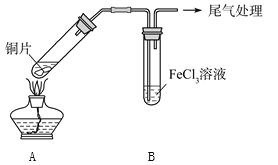
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A |
FeCl3溶液显酸性的原因是__________________。写出装置A中产生SO2的化学方程式:_______________________________。
(2)当SO2通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】[Fe(HSO3)]2+为红棕色,它可以将Fe3+还原为Fe2+。生成
[Fe(HSO3)]2+的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_________________________。
写出溶液中[Fe(HSO3)]2+与Fe3+反应的离子方程式: ________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②、③的实验。
步骤② | 往5 mL 1 mol·L-1FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
步骤③ | 往5 mL重新配制的1 mol·L-1FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为____________________。
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com