
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧C、D的分子数之比为1∶1
A. ②③④⑤ B. ①③⑤⑦ C. ②③⑤⑦ D. ②③⑤⑥
【答案】C
【解析】①、该反应为气体体积不变的反应,压强为不变量,所以混合气体的压强不变时,不能说明该反应达到平衡状态,故①错误;
②、该反应中A物质是固体,容器容积不变,混合气体总质量为可变量,则密度也为可变量,所以密度不变时,可以说明反应达到平衡状态,故②正确;
③、B的物质的量浓度不变时,说明正逆反应速率相等,该反应达到平衡状态,故③正确;
④、该反应为气体体积不变的反应,则混合气体的总物质的量为不变量,当混合气体的总物质的量不变时,不能说明该反应达到平衡状态,故④错误;
⑤、根据方程式可知,混合气体的总质量为可变量,总物质的量为不变量,则混合气体的平均相对分子质量为可变量,当混合气体的平均相对分子质量不变时,说明各组分的浓度不再变化,达到平衡状态,故⑤正确;
⑥、虽然v(C)与v(D)的比值不变,但由于未说明二者表示的是正速率还是逆速率,则无法判断平衡状态,故⑥错误;
⑦、该反应中A物质是固体,则混合气体的总质量是可变量,所以混合气体的总质量不变,说明反应达到了平衡状态,故⑦正确;
⑧、C. D的分子数之比为1:1,无法判断各组分的浓度是否不再变化,则无法判断平衡状态,故⑧错误;
所以此题符合题意的是:②③⑤⑦,故答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:
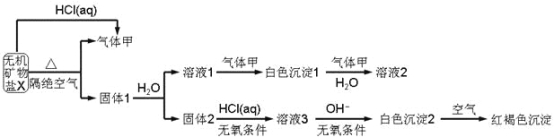
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法错误的是
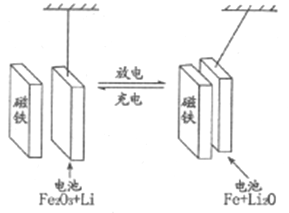
A. 放电时,负极的电极反应式为Li-e-=Li+
B. 放电时,电子通过电解质从Li流向Fe2O3
C. 充电时,Fe做阳极,电池逐渐摆脱磁铁吸引
D. 充电时,阳极的电极反应式为2Fe+3Li2O-6e-= Fe2O3+6Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃的1个分子中含有9个碳原子,其一氯代物只有两种,该烷烃的名称是( )
A.正壬烷B.2,6-二甲基庚烷
C.2,2,4,4-四甲基戊烷D.2,3,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据题目提供的溶度积数据进行计算并回答下列问题:
(1)在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(CO32-)=10-3mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。[已知c(Ca2+)≤10-5mol·L-1时可视为沉淀完全,Ksp(CaCO3)=4.96×10-9]
(2)已知25℃时,Ksp[Mg(OH)2]=4.0×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________。
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________ mol·L-1。
②完全沉淀后,溶液的pH=__________。
(4) 已知常温下Ksp[Fe(OH)3]=1×10-39,某CuSO4溶液中含有Fe3+,可以加入_________调节溶液的pH=___________使溶液中的c(Fe3+)=10-5 mol/L除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,7.0 g由丁烯与丙烯组成的混合气体中含有的氢原子数目为NA
B. T ℃时,1 L pH=6的纯水中,含OH-的数目为10-8NA
C. 向1 L的密闭容器中充入46 g NO2气体,容器中气体的分子数为NA
D. 标准状况下,1 mol Na2O2与22.4 L SO2反应,转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C的原子半径在所有短周期主族元素中最大,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005 mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述一定正确的是
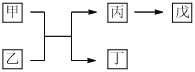
A. C、D两元素形成的化合物的原子个数比为1:2
B. C、E形成的化合物的水溶液呈碱性
C. 简单离子半径:D> C> B
D. 最高价氧化物对应水化物的酸性:E>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸”Na—CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。“吸入”CO2时,其工作原理如下图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法中错误的是
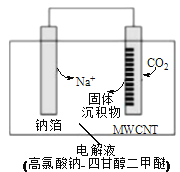
A. “吸入”CO2时,电流流向为:MWCNT→导线→钠箔
B. “呼出”CO2时,Na+向多壁碳纳米管电极移动
C. 放电时,正极的电极反应式为:3CO2+4Na++4e-=2Na2CO3+C
D. 电解液选用高氯酸钠-四甘醇二甲醚的优点是导电性好,与金属钠不反应,难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为周期表中前20号元素中的四种,原子序数依次增大,
为周期表中前20号元素中的四种,原子序数依次增大,![]() 为金属元素,
为金属元素,![]() 原子的最外层电子数是次外层电子数的3倍,
原子的最外层电子数是次外层电子数的3倍,![]() 位于同周期,
位于同周期,![]() 单质是一种良好的半导体.
单质是一种良好的半导体.![]() 能与冷水剧烈反应,
能与冷水剧烈反应,![]() 原子的最外层电子数之和与
原子的最外层电子数之和与![]() 原子的最外层电子数之和相等.下列说法正确的是
原子的最外层电子数之和相等.下列说法正确的是
A. 原子半径:![]() B. 气态氢化物的稳定性:
B. 气态氢化物的稳定性:![]()
C. 最高价氧化物对应水化物的碱性:![]() D.
D. ![]()
![]() 中共价键的数目为
中共价键的数目为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com