
(16分)
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
1/4CaSO4(s)+CO(g) ? 1/4CaS(s)+CO2(g) ?H1 = -47.3kJ?mol-1
② CaSO4(s)+CO(g) ? CaO(s)+CO2(g) +SO2(g) ?H2 = +210.5kJ?mol-1
③ CO(g) ? 1/2C(s)+1/2CO2(g) ?H3 = -86.2kJ?mol-1
(1)反应2CaSO4(s)+7CO(g) ? CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)
的?H=__________(用?H1、?H2和?H3表示)
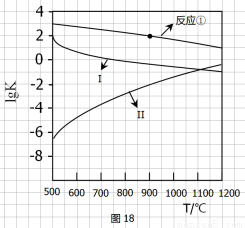
(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图18,结合各反应的?H,回答下列问题。a)曲线中对应反应②的是_______(选填“Ⅰ”或“Ⅱ”)。
归纳lgK-T曲线变化规律: b)_________ ________ 。
c)_____ ___ 。
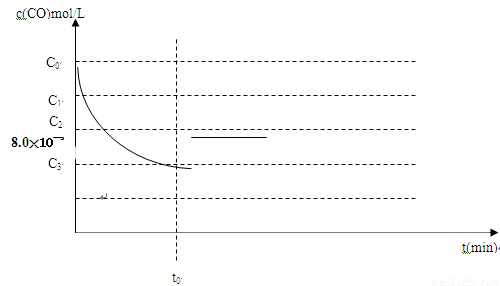
(3)向盛有CaSO4的真空恒容密闭容器中充入初始浓度为C0 mol?L-1 的CO,反应①于900℃
达到平衡,此时c平衡(CO)=8.0X10-5 mol?L-1。
d)用图18中相应的lgK的值计算CO的转化率(忽略副反应,计算结果保留两位有效数字)。
e) c(CO)随反应时间t的变化曲线如图19所示。
若保持其他条件不变,请在答题卡坐标图中分别画出升高反应温度(高于900℃)和降低反应温度(低于900℃)c(CO)随反应时间t的变化曲线图,并作相应的标注(忽略副反应)。
(1)4?H1+?H2+2?H3(2分)(2)a)Ⅱ(2分)
b)当?H>0时,lgK随温度升高而增大(1分),当?H<0时,lgK随温度升高而减小(1分)。其他合理答案也给分
c) 当温度同等变化时,?H的数值越大lgK的变化越大或?H的数值越大lgK受温度的影响越大或放热越多,lgK受温度的影响越大(2分)。其他合理答案也给分
(3)d)α(CO)=99%(4分)e)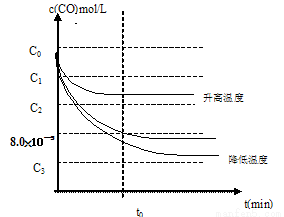
【解析】
试题分析:(1)①×4+②+③×2,整理可得:2CaSO4(s)+7CO(g) ? CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)
?H=4?H1+?H2+2?H3;(2)a)由于温度升高,曲线中lgK随温度升高而增大,说明升高温度,平衡正向移动,正反应是吸热反应,?H>0则对应反应②的是Ⅱ;归纳lgK-T曲线变化规律: b) 当?H>0时,lgK随温度升高而增大(1分),当?H<0时,lgK随温度升高而减小(1分)。
c) 当温度同等变化时,?H的数值越大lgK的变化越大或?H的数值越大lgK受温度的影响越大或放热越多,lgK受温度的影响越大(2分)。(3)d)
1/4CaSO4(s)+CO(g)  1/4CaS(s)+CO2(g)
1/4CaS(s)+CO2(g)
初始浓度(mol/L) C0 0
转化浓度(mol/L) C0 — 8.0X10-5 C0 — 8.0X10-5
平衡浓度(mol/L) 8.0X10-5 C0 — 8.0X10-5 (1分)
K= c( CO2 )/ (c(CO)=100(1分),解得:C0=808×10-5(1分)所以α(CO)=99%(1分)
e)由于2CaSO4(s)+7CO(g) ? CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g) ?H=4?H1+?H2+2?H3=-151.1KJ/mol;
该反应的正反应是放热反应,升高温度,根据平衡移动原理:化学平衡向吸热反应反应方向移动,对该反应来说,平衡逆向移动,CO的浓度增大;降低温度,平衡正向移动,CO的浓度减小。所以画出图像表示为: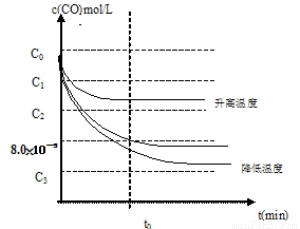 。
。
考点:考查盖斯定律的应用、热化学方程式的书写、化学平衡常数的计算、温度对物质平衡浓度影响的图像法表示的知识。


科目:高中化学 来源: 题型:
| A、AlCl3溶液中滴入过量NaOH溶液 | B、Fe2(SO4)3溶液中加入过量铁粉 | C、稀HNO3中加入少量铜片 | D、Ca(ClO)2溶液中通入过量CO2 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是(N-14 O-16 C-12 H-1)
A.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
B.标准状况下,22.4 L CH2Cl2中含有的氯原子数目为2NA
C.16g CH4与18 g NH4+ 所含质子数相等
D.1molCu在足量硫蒸气中反应时转移2NA个电子
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:填空题
(16分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
物 质 | CH4 | CO2 | CO | H2 |
平衡浓度(mol·L-1) | 0.5 | 0.5 | 2.0 | 2.0 |
① 此温度下,该反应的平衡常数K=________(注明单位).
② 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应: CO2+CH4  CH3COOH, 请回答:
CH3COOH, 请回答:
① 温度与催化剂的催化效率和乙酸的生成速率如图。

250~300℃时,温度升高而乙酸的生成速率降低的原因是____ 。
② 为提高上述反应CH4的转化率,可采取的措施有 (写2种)。
③ Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
① 若寻找吸收CO2的其他物质,下列建议合理的是___。
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
② Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列装置、试剂选用或操作正确的是
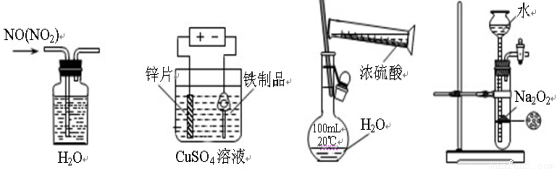
A.除去NO中的NO2 B.铁制品表面镀锌 C.稀释浓硫酸 D.制备少量O2
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| X | Y | Z |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | SiO2 | 稀盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(16分)目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方。“达菲”的主要合成原料是我国盛产的莽草酸。从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒。下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构)。
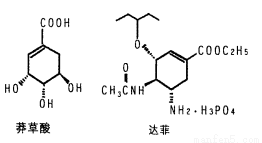
(1)“达菲”的相对分子质量为410.4,扣除H3PO4后的部分称为“自由基奥司他韦”。试求“自由基奥司他韦”的相对分子质量________;“自由基奥司他韦”能与磷酸结合,说明氨基具有________性。
(2)莽草酸中含有的官能团有__________________________(写名称)。
(3)下列有关莽草酸的说法中正确的是____________________________。
①分子式为C7H10O5
②能使FeCl3溶液显紫色
③能使溴的四氯化碳溶液褪色
④l mol莽草酸与分别足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为4:l
(4)莽草酸与C2H5OH发生酯化反应的化学方程式是_________________。
(5)莽草酸在浓硫酸作用下加热可得到B(C7H6O3),B的同分异构体中既含有酚羟基又含有酯基的共有______种,写出其中一种同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,16 g O2含有nA个氧原子
B.1mol苯含有3nA个碳碳单键和3nA个碳碳双键
C.一定条件下,3molH2和1molN2充分反应后,可得到2nA个NH3分子数
D.1 mol·L-1 FeCl3溶液中含有Cl-总数为3nA
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关说法正确的是
A.NF3既是氧化剂,又是还原剂
B.还原剂与氧化剂的物质的量之比为2∶1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生无色气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com