
分析 加铁粉,发生反应Fe+2Fe3+=3Fe2+,根据反应可知0.2molFe3+完全被还原只需要0.1molFe,从而可计算出反应后溶液中亚铁离子的物质的量,然后根据c=$\frac{n}{V}$计算出反应后溶液中Fe2+的物质的量浓度.
解答 解:加入铁粉,发生Fe+2Fe3+=3Fe2+,溶液中含0.2molFe3+,待Fe3+完全还原后,由反应可知消耗Fe的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,
Fe有剩余,反应生成Fe2+为0.2mol×$\frac{3}{2}$=0.3mol,则反应后溶液中含Fe2+的物质的量为:0.1mol+0.3mol=0.4mol,
所以溶液中Fe2+的物质的量浓度为:$\frac{0.4mol}{0.5L}$=0.8mol/L,
故答案为:0.8mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
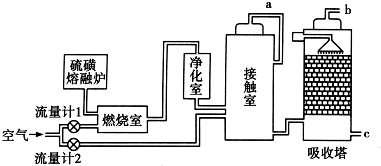
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
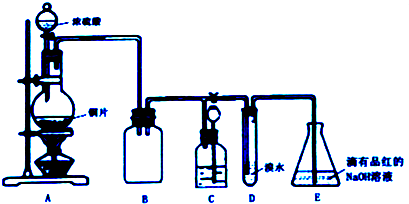
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | II | |
| ③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3、BaSO4、Na2CO3 | B. | CuSO4、NaCl、NaCO3 | ||
| C. | NaCl、CuSO4、CaCO3 | D. | NaCl、KNO3、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
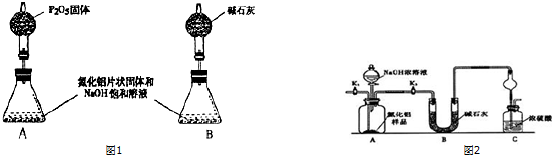
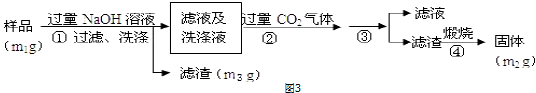
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
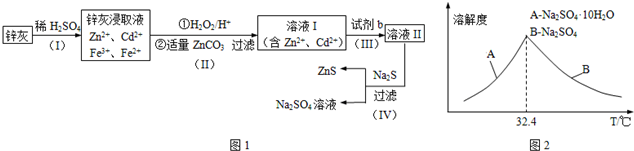
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
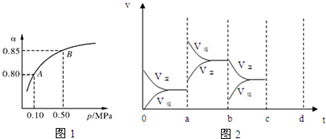
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com