
 ClO2��һ�ָ�Чˮ��������ijʵ��С������ͼ��ʾװ����ȡ���ռ�Cl02����֪����ClO2Ϊ����ɫ���壬��������ˮ���۵�-59C���е�11�棬����ǿ�����ԣ�
ClO2��һ�ָ�Чˮ��������ijʵ��С������ͼ��ʾװ����ȡ���ռ�Cl02����֪����ClO2Ϊ����ɫ���壬��������ˮ���۵�-59C���е�11�棬����ǿ�����ԣ�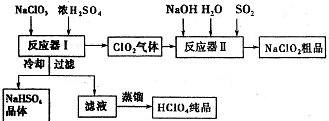
���� ��1������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�
��2��Bװ��Ҫ�����ڱ�ˮ�У����������ռ���
��3����Ӧ���ɶ�����̼������ϡ��ClO2��
��4���ٳ��������ձ����ܽ⣬���ò��������裬����100mL����ƿ�У���ˮ����������ƿ�̶���1-2cm�����ý�ͷ�ιܶ��ݣ�
���ɷ�Ӧ�ɵù�ϵʽ��2ClO2��5I2��10S2O32-�����ݹ�ϵʽ����ClO2�����ʵ���Ũ�ȣ����������京����
��5����������ͼ��֪����Ӧ��I��Ũ�����������Ʒ�Ӧ����ClO2��NaClO2���������ƣ�
�ڷ�Ӧ��������ClO2��NaOH��SO2��Ӧ����NaClO2�����ݵ���ת���غ㣬SO2������Ϊ�����ƣ�
��HClO2��ǿ�ᣬNaClO2��Һ�����ԣ��ⶨ��ҺpH�жϣ�
��� �⣺��1��Aװ���е綯�����������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�
�ʴ�Ϊ����Ӧʱ���裬����Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�
��2��ClO2��һ�ֻ���ɫ���д̼�����ζ�����壬�۵㣺-59.0�棬�е㣺11.0�棬Bװ��Ҫ�����ڱ�ˮ�У�ʹClO2 �����������ռ���
�ʴ�Ϊ��ʹClO2 �����������ռ���
��3����Ϣ����ClO2�ױ�ը�����á��������塱��ϡ��ʱ����ը�Ŀ����Դ�ͣ�����Ӧ���ɶ�����̼������ϡ��ClO2������˱�ը�Ŀ����ԣ�
�ʴ�Ϊ����Ӧ���ɶ�����̼������ϡ��ClO2������˱�ը�Ŀ����ԣ�
��4���ٳ��������ձ����ܽ⣬���ò��������裬����100mL����ƿ�У���ˮ����������ƿ�̶���1-2cm�����ý�ͷ�ιܶ��ݣ�
�ʴ�Ϊ��100mL����ƿ��
���ɷ�Ӧ�ɵù�ϵʽ��2ClO2��5I2��10S2O32-����֪V1mL��c��ClO2����V2mL��c��Na2S2O3��=2��10����V1mL��c��ClO2����V2mL��c mol��L-1����c��ClO2��=$\frac{c{V}_{2}}{5{V}_{1}}$mol/L�����京��Ϊ$\frac{c{V}_{2}}{5{V}_{1}}$mol/L��67.5g/mol=$\frac{13.5c{V}_{2}}{{V}_{1}}$g/L��
�ʴ�Ϊ��$\frac{13.5c{V}_{2}}{{V}_{1}}$g/L��
��5����������ͼ��֪����Ӧ��I��Ũ�����������Ʒ�Ӧ����ClO2��NaClO2���������ƣ���Ӧ����ʽΪ��3NaClO3+3H2SO4��Ũ��=HClO4+2ClO2��+3NaHSO4+H2O��
�ʴ�Ϊ��3NaClO3+3H2SO4��Ũ��=HClO4+2ClO2��+3NaHSO4+H2O��
�ڷ�Ӧ��������ClO2��NaOH��SO2��Ӧ����NaClO2�����ݵ���ת���غ㣬SO2������Ϊ�����ƣ���Һ���ӷ���ʽΪ��2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O��
�ʴ�Ϊ��2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O��
��HClO2��ǿ�ᣬNaClO2��Һ�����ԣ������ⶨ��Ӧ��������Һ��pH�������ж�NaOH�Ƿ�������ʴ�Ϊ�������ⶨ��Ӧ��������Һ��pH��
���� ���⿼�������Ʊ�ʵ���빤�����̣�ע�����Ŀ��Ϣ��Ӧ�ã��ϺõĿ���ѧ����ȡ��Ϣ��������֪ʶǨ�����ã��Ѷ��еȣ�


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������£�CH3CO18OC2H5ˮ��IJ�����CH3CO18OH��C2H5OH | |
| B�� | �øʰ��ᣨH2NCH2COOH���ͱ����ᣨCH3CHNH2COOH��������ϣ������γ�3�ֶ��� | |
| C�� | ����ȩ�л��б����ᣬ������ʯ�ң��ټ������� | |
| D�� | ����ʯ�뱥��ʳ��ˮ��Ӧ���ɵ�����ͨ��������Ȼ�̼��Һ�У�����Һ��ɫ��֤������Ȳ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
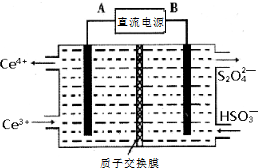
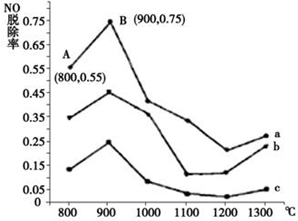 �����������γ����ꡢ�����Ȼ�����Ⱦ��������ף����ú��ʵĴ�ʩ��������Ⱦ�DZ�����������Ҫ�ٴ룮
�����������γ����ꡢ�����Ȼ�����Ⱦ��������ף����ú��ʵĴ�ʩ��������Ⱦ�DZ�����������Ҫ�ٴ룮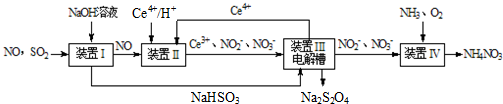
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 L HF�к�HF������ĿΪNA | |
| B�� | 60 gʯӢ�����к��е�Si-O����ĿΪ2 NA | |
| C�� | ��״���£�11.2 L Cl2ͨ��������ʯ�������Ʊ�Ư�ۣ�ת�Ƶĵ�����Ϊ0.5 NA | |
| D�� | l L 0.1 mol/L��NaHCO3��Һ��HCO3-��CO32-������֮��Ϊ0.1 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ù����������ᷴӦ�Ʊ��轺��SiO32-+2H+�TH2SiO3�����壩 | |
| B�� | FeI2��Һ��ͨ������Cl2��2Fe2++Cl2�T2Fe3++2Cl- | |
| C�� | ����NaHSO4 ��Һ��Ba��OH��2 ��Һ��Ӧ��H++OH-+SO42-+Ba2+�TH2O+BaSO4�� | |
| D�� | FeCl3��Һ��ͨ��SO2����Һ��ɫ��ȥ��2Fe3++SO2+2H2O�T2Fe2++SO42-+4H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʽ����XY2�͵Ļ����������ͬһ����Ԫ�ع��� | |
| B�� | ֻ����ԭ���У���������������������� | |
| C�� | Ŀǰʹ�õ�Ԫ�����ڱ��У�������ں���36��Ԫ�� | |
| D�� | ���еķǽ���Ԫ�ض�λ��Ԫ�����ڱ����Ұ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ع��͡���ֹʳ�ã������������Ʒ��� | |
| B�� | ����������̼�����ƶ�����������θ����� | |
| C�� | Ϊ����ʳ���ɫ���㡢ζ����ֹ���ʣ��������м�������ʳƷ���Ӽ� | |
| D�� | �û�����������������ϣ��Լ��ٶ�����̼���ŷ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com