
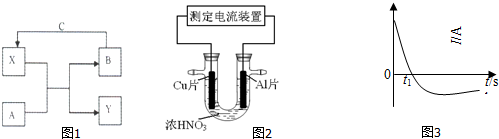
分析 A、B为单质,X、Y为化合物,则A与X的反应为置换反应,C为地壳中含量最多的元素形成的单质,应为O2,则X为氧化物,
(1)若X是光导纤维的主要成分,应为SiO2,则B为Si,二氧化硅与碳反应生成CO和硅,所以Y为CO,A为C;
(2)若X是一种黑色磁性物质,应为Fe3O4,且Y具有两性,应为Al2O3,则A为Al,B为Fe;
(3)若组成A的元素在短周期中(稀有气体除外)原子半径最大,应为Na,B为气体,应为H2,则X为H2O,Y为NaOH;
(4)铜和铝插入浓HNO3中组成原电池,开始阶段,铝的还原性强于铜,铝做原电池的负极,发生的原电池反应为铝与硝酸的反应,随着反应的进行,铝被钝化,铜做负极,发生的原电池反应是铜与浓硝酸反应,据此分析解答.
解答 解:A、B为单质,X、Y为化合物,则A与X的反应为置换反应,C为地壳中含量最多的元素形成的单质,应为O2,则X为氧化物,
(1)若X是光导纤维的主要成分,应为SiO2,则B为Si,二氧化硅与碳反应生成CO和硅,所以Y为CO,A为C,
故答案为:CO;
(2)若X是一种黑色磁性物质,应为Fe3O4,且Y具有两性,应为Al2O3,则A为Al,B为Fe,Al与氢氧化钠溶液反应的离子方程式为2Al+2OH-+H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+H2O=2AlO2-+3H2↑;
(3)若组成A的元素在短周期中(稀有气体除外)原子半径最大,应为Na,B为气体,应为H2,则X为H2O,Y为NaOH,形成碱性氢氧源电池时,负极发生氧化反应,电极方程式为H2-2e-+2OH-=2H2O,
故答案为:H2-2e-+2OH-=2H2O;
(4)铜和铝插入浓HNO3中组成原电池,开始阶段,铝的还原性强于铜,铝做原电池的负极,发生的原电池反应为铝与硝酸的反应,此时氢离子向铜电极方向移动,随着反应的进行,铝被钝化,铜做负极,发生的原电池反应是铜与浓硝酸反应,电池的正极反应式为2H++NO3-+e-=NO2+H2O,
故答案为:Cu;Al遇浓硝酸钝化;2H++NO3-+e-=NO2+H2O.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,注意把握转化关系,结合中学常见有氧化物参加的置换反应以及题目要求解答该题,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 28.1 | B. | 30.2 | C. | 33.1 | D. | 34.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如图所示装置,为实现下列实验目的
现有如图所示装置,为实现下列实验目的查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,向纯水中加入少量盐酸,[H+]增大,Kw将增大 | |
| B. | 25℃时,将pH=9的烧碱溶液稀释1000倍所得到的溶液,PH=6 | |
| C. | 25℃时,水的离子积常数Kw为1×10-14mol2•L-2 | |
| D. | 100℃时,纯水的pH=6,此时溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl中有离子键,是离子化合物 | |
| B. | 46g C2H5OH燃烧放出的热量为乙醇的燃烧热 | |
| C. |  和 和 互为同系物 互为同系物 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测定Na2CO3溶液的pH | |
| B. | 从食盐水中提取NaCl | |
| C. | 用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2 | |
| D. | 配制100ml 0.1000mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热.冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 测定中和热 | 取0.5mol.L-1的盐酸与0.55mol.L-1的NaOH溶液各50ml混合用量热器测定温度变化. |
| D | 验证浓度对化学平衡的影响 | 向0.1mol.L-1的重铬酸钾溶液中滴几滴浓硫酸观察颜色,再滴几滴NaOH溶液观察颜色变化. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com