
| A. | N2 | B. | CO2 | C. | BF3 | D. | PCl3 |
分析 判断成键原子的最外层是否满足8电子稳定结构,可根据原子的价电子数与化合物中的元素的化合价的绝对值之和是否等于8判断.
解答 解:A.N2中,N与N原子之间有3个共用电子对,则N原子的最外层电子为5+3=8,满足8电子稳定结构,故A不选;
B.CO2中,C的价电子数为4,化合价为+4价,C的最外层数为4+4=8,满足8电子稳定结构,O的价电子数为6,化合价为-2价,Cl的最外层电子数为6+|-2|=8,满足8电子稳定结构,故B不选;
C.BF3中,B的价电子数为3,化合价为+3价,C的最外层数为3+3=6,不满足8电子稳定结构,F的价电子数为7,化合价为-1价,F的最外层电子数为7+|-1|=8,满足8电子稳定结构,故C选;
D.PCl3中,P的价电子数为5,化合价为+3价,C的最外层数为5+3=8,满足8电子稳定结构,Cl的价电子数为7,化合价为-1价,Cl的最外层电子数为7+|-1|=8,满足8电子稳定结构,故D不选.
故选C.
点评 本题考查原子核外电子排布和化合价问题,题目难度不大,注意判断核外是否满足8电子的结构的角度.


科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
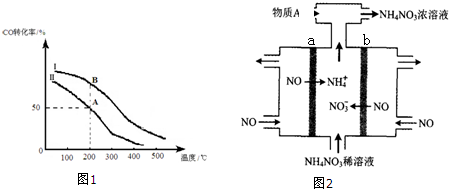
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将碳、氢元素符号省略,只表示分子中键的连接情况 | |
| B. | 每个拐点、交点、端点均表示有一个碳原子 | |
| C. | 每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数即是氢原子数 | |
| D. | C=C、C≡C键等官能团中的“=”和“≡”也可以省略 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚二氧化碳塑料是通过加聚反应制得的 | |
| B. | 聚二氧化碳塑料与干冰互为同素异形体 | |
| C. | 聚二氧化碳塑料与干冰都属于纯净物 | |
| D. | 聚二氧化碳塑料的使用会产生白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Z的氢化物结构式为
;Z的氢化物结构式为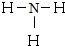 ;写出U元素在周期表中的位置第三周期第VIA族.
;写出U元素在周期表中的位置第三周期第VIA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室可用如图所示装置进行多个实验探究,请回答下列问题.
实验室可用如图所示装置进行多个实验探究,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s1 | B. | 1s22s22p5 | ||
| C. | 1s22s22p63s2 | D. | 1s22s22p63s23p64s1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com