
(10分)烧结法制氧化铝生产过程如下:
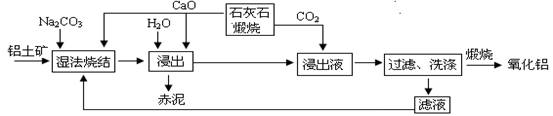
已知:①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。 ②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解化学反应方程式 ▲ 。
(2)浸出时再加入CaO的目的是 ▲ 。
(3)浸出液中发生的生成Al(OH)3的离子反应方程式 ▲ 。
(4)滤液的主要成分是 ▲ (写化学式);滤液循环使用的优点 ▲ 。(任答一点)
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)烧结法制氧化铝生产过程如下:
已知:①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。 ②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解化学反应方程式 ▲ 。
(2)浸出时再加入CaO的目的是 ▲ 。
(3)浸出液中发生的生成Al(OH)3的离子反应方程式 ▲ 。
(4)滤液的主要成分是 ▲ (写化学式);滤液循环使用的优点 ▲ 。(任答一点)
查看答案和解析>>
科目:高中化学 来源:2011届江苏省淮安市高三第四次调研测试化学试卷 题型:填空题
(10分)烧结法制氧化铝生产过程如下:
已知:①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。 ②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解化学反应方程式 ▲ 。
(2)浸出时再加入CaO的目的是 ▲ 。
(3)浸出液中发生的生成Al(OH)3的离子反应方程式 ▲ 。
(4)滤液的主要成分是 ▲ (写化学式);滤液循环使用的优点 ▲ 。(任答一点)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com