
”¾ĢāÄæ”æŅŃÖŖ³£ĪĀŹ±HClOµÄKa=3.0”Į10-8£¬HFµÄKa=3.5”Į10-4”£ĻÖ½«pHŗĶĢå»ż¶¼ĻąĶ¬µÄ“ĪĀČĖįŗĶĒā·śĖįČÜŅŗ·Ö±š¼ÓÕōĮóĖ®Ļ”ŹĶ£¬pHĖęČÜŅŗĢå»żµÄ±ä»ÆČēĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ

A. ĒśĻßIĪŖ“ĪĀČĖįĻ”ŹĶŹ±pH±ä»ÆĒśĻß
B. Č”aµćµÄĮ½ÖÖĖįČÜŅŗ£¬ÖŠŗĶĻąĶ¬Ģå»ż”¢ĻąĶ¬ÅØ¶ČµÄNaOHČÜŅŗ£¬ĻūŗÄ“ĪĀČĖįµÄĢå»ż½ĻŠ”
C. aµćŹ±£¬Čō¶¼¼ÓČėĻąĶ¬“󊔵ĊæĮ££¬“ĖŹ±ÓėĒā·śĖį·“Ó¦µÄĖŁĀŹ“ó
D. bµćČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č±ČcµćČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶ČŠ”
”¾“š°ø”æB
”¾½āĪö”æ³£ĪĀĻĀKa£ØHClO£©![]() Ka£ØHF£©£¬ĖįŠŌ£ŗHClO
Ka£ØHF£©£¬ĖįŠŌ£ŗHClO![]() HF£¬øł¾ŻĶ¼Ļń½«pHŗĶĢå»ż¶¼ĻąĶ¬µÄHClOŗĶHFĻ”ŹĶĶ¬µČ±¶Źż£¬IµÄpHøıäÖµ“óÓŚIIµÄpHøıäÖµ£¬ĒśĻßI“ś±ķĻ”ŹĶHFŹ±pH±ä»ÆĒśĻߣ¬ĒśĻßII“ś±ķĻ”ŹĶHClOŹ±pH±ä»ÆĒśĻß”£AĻī£¬øł¾ŻÉĻŹö·ÖĪö£¬ĒśĻßIĪŖHFĻ”ŹĶŹ±pH±ä»ÆĒśĻߣ¬AĻī“ķĪó£»BĻī£¬aµćHClOČÜŅŗŗĶHFČÜŅŗµÄpHĻąĶ¬£¬aµćc£ØHClO£©“óÓŚc£ØHF£©£¬Č”aµćµÄĮ½ÖÖĖįČÜŅŗÖŠŗĶĻąĶ¬Ģå»ż”¢ĻąĶ¬ÅØ¶ČµÄNaOHČÜŅŗ£¬ĻūŗÄHClOČÜŅŗµÄĢå»ż½ĻŠ”£¬BĻīÕżČ·£»CĻī£¬aµćHClOČÜŅŗŗĶHFČÜŅŗµÄpHĻąĶ¬£¬¼“aµćĮ½ČÜŅŗÖŠc£ØH+£©ĻąµČ£¬“ĖŹ±ÓėĻąĶ¬“󊔵ĊæĮ£·“Ó¦µÄ·“Ó¦ĖŁĀŹĻąµČ£¬CĻī“ķĪó£»DĻī£¬ĖįČÜŅŗÖŠOH-Č«²æĄ“×ŌĖ®µÄµēĄė£¬øł¾ŻĶ¼ĻńbµćČÜŅŗµÄpH“óÓŚcµćČÜŅŗµÄpH£¬bµćČÜŅŗÖŠc£ØH+£©Š”ÓŚcµćČÜŅŗÖŠc£ØH+£©£¬bµć¶ŌĖ®µÄµēĄėµÄŅÖÖĘŠ”ÓŚcµć£¬bµćČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č±ČcµćČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č“ó£¬DĻī“ķĪ󣻓š°øŃ”B”£
HF£¬øł¾ŻĶ¼Ļń½«pHŗĶĢå»ż¶¼ĻąĶ¬µÄHClOŗĶHFĻ”ŹĶĶ¬µČ±¶Źż£¬IµÄpHøıäÖµ“óÓŚIIµÄpHøıäÖµ£¬ĒśĻßI“ś±ķĻ”ŹĶHFŹ±pH±ä»ÆĒśĻߣ¬ĒśĻßII“ś±ķĻ”ŹĶHClOŹ±pH±ä»ÆĒśĻß”£AĻī£¬øł¾ŻÉĻŹö·ÖĪö£¬ĒśĻßIĪŖHFĻ”ŹĶŹ±pH±ä»ÆĒśĻߣ¬AĻī“ķĪó£»BĻī£¬aµćHClOČÜŅŗŗĶHFČÜŅŗµÄpHĻąĶ¬£¬aµćc£ØHClO£©“óÓŚc£ØHF£©£¬Č”aµćµÄĮ½ÖÖĖįČÜŅŗÖŠŗĶĻąĶ¬Ģå»ż”¢ĻąĶ¬ÅØ¶ČµÄNaOHČÜŅŗ£¬ĻūŗÄHClOČÜŅŗµÄĢå»ż½ĻŠ”£¬BĻīÕżČ·£»CĻī£¬aµćHClOČÜŅŗŗĶHFČÜŅŗµÄpHĻąĶ¬£¬¼“aµćĮ½ČÜŅŗÖŠc£ØH+£©ĻąµČ£¬“ĖŹ±ÓėĻąĶ¬“󊔵ĊæĮ£·“Ó¦µÄ·“Ó¦ĖŁĀŹĻąµČ£¬CĻī“ķĪó£»DĻī£¬ĖįČÜŅŗÖŠOH-Č«²æĄ“×ŌĖ®µÄµēĄė£¬øł¾ŻĶ¼ĻńbµćČÜŅŗµÄpH“óÓŚcµćČÜŅŗµÄpH£¬bµćČÜŅŗÖŠc£ØH+£©Š”ÓŚcµćČÜŅŗÖŠc£ØH+£©£¬bµć¶ŌĖ®µÄµēĄėµÄŅÖÖĘŠ”ÓŚcµć£¬bµćČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č±ČcµćČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č“ó£¬DĻī“ķĪ󣻓š°øŃ”B”£


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶعż»ÆѧĘōĆÉѧĻ°£¬Ķ¬Ń§ĆĒ¶Ō×é³ÉĶņĪļµÄ»ł±¾ĪļÖŹÓŠĮĖ½ųŅ»²½ĮĖ½ā”£
£Ø1£©ĻÖÓŠH”¢C”¢N”¢O”¢KĪåÖÖŌŖĖŲ£¬ĒėŃ”ÓĆĘäÖŠµÄŌŖĖŲŠ“³öĻĀĮŠĪļÖŹµÄ»ÆѧŹ½£ŗ
¢ŁĢģČ»ĘųµÄÖ÷ŅŖ³É·Ö____£»
¢Ś¼«Ņ×ÓėŃŖŗģµ°°×½įŗĻµÄÓŠ¶¾ĘųĢå____£»
¢ŪÄܹ©øųŗōĪüµÄĘųĢå____£»
¢ÜæÉ×÷ø“ŗĻ·ŹµÄĻõĖį¼Ų____”£
£Ø2£©ČēĶ¼ŹĒijŌÉŹÆѳʷ֊ø÷ÖÖŌŖĖŲŗ¬ĮæµÄ±ČĄżĶ¼”£

¢ŁøĆŌÉŹÆÖŠŗ¬____ÖÖ·Ē½šŹōŌŖĖŲ£¬ĘäÖŠŗ¬ÓŠĮæ×ī¶ąµÄŹĒ____ŌŖĖŲ”£
¢ŚÄĘĄė×ӵĽį¹¹Ź¾ŅāĶ¼ĪŖ £¬ŌņX£½____”£
£¬ŌņX£½____”£
¢Ū“ĖŌÉŹÆѳʷ֊²»æÉÄÜŗ¬ÓŠµÄ»ÆŗĻĪļŹĒ____”£
A£®CaCO3 B£®K2SO4 C£®Al2O3 D£®SiO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Æѧµē³ŲŌŚĶØѶ”¢½»Ķؼ°ČÕ³£Éś»ī֊ӊ׏ć·ŗµÄÓ¦ÓĆ”£
£Ø1£©Zn©MnO2øɵē³ŲÓ¦ÓĆ¹ć·ŗ£¬Ęäµē½āÖŹČÜŅŗŹĒZnCl2©NH4Cl»ģŗĻČÜŅŗ”£øƵē³ŲµÄøŗ¼«²ÄĮĻŹĒ______£®µē³Ų¹¤×÷Ź±£¬µē×ÓĮ÷Ļņ______£ØĢī”°Õż¼«”±»ņ”°øŗ¼«”±£©”£
ČōZnCl2©NH4Cl»ģŗĻČÜŅŗÖŠŗ¬ÓŠŌÓÖŹCu2+£¬»į¼ÓĖŁÄ³µē¼«µÄ·“Ó¦£®ĘäÖ÷ŅŖŌŅņŹĒ_________________”£
£Ø2£©Ē¦Šīµē³ŲŹĒ³£ÓƵĻÆѧµēŌ“£¬Ęäµē¼«²ÄĮĻ·Ö±šŹĒPbŗĶPbO2£¬µē½āŅŗĪŖĮņĖį”£øƵē³Ų×Ü·“Ó¦Ź½ĪŖ£ŗ
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O”£Ēėøł¾ŻÉĻŹöĒéæöÅŠ¶Ļ£ŗ
2PbSO4+2H2O”£Ēėøł¾ŻÉĻŹöĒéæöÅŠ¶Ļ£ŗ
øĆŠīµē³Ų·ÅµēŹ±£¬µē½āÖŹČÜŅŗÖŠŅõĄė×ÓŅĘĻņ_____________£ØĢī”°Õż¼«”±»ņ”°øŗ¼«”±£©£»Õż¼«ø½½üČÜŅŗµÄĖįŠŌ_______£ØĢī”°ŌöĒæ”±”¢”°¼õČõ”±»ņ”°²»±ä”±£©·ÅµēŹ±£¬øŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ________________”£
£Ø3£©ĒāŃõČ¼ĮĻµē³Ų¾ßÓŠĘō¶Ææģ”¢Š§ĀŹøßµČÓÅµć£¬ĘäÄÜĮæĆܶČøßÓŚĒ¦Šīµē³Ų”£Čōµē½āÖŹĪŖKOHČÜŅŗ£¬ŌņĒāŃõČ¼ĮĻµē³ŲµÄøŗ¼«·“Ó¦Ź½ĪŖ_________________________________”£øƵē³Ų¹¤×÷Ź±£¬ĶāµēĀ·ĆæĮ÷¹ż2 mole-£¬ĻūŗıźæöĻĀŃõĘų____________L”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌĻćĄ¼Č©(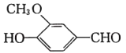 )ĪŖÖ÷ŅŖŌĮĻŗĻ³ÉŅ©ĪļĄū“±“(V)µÄĮ÷³ĢČēĻĀ£ŗ
)ĪŖÖ÷ŅŖŌĮĻŗĻ³ÉŅ©ĪļĄū“±“(V)µÄĮ÷³ĢČēĻĀ£ŗ
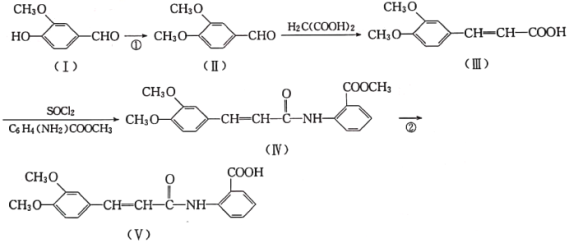
ŅŃÖŖ£ŗ![]() (õ£°·¼ü)ŌŚĪŽėļüĆø×÷ÓĆĻĀµÄĖ®½āæÉŗöĀŌ”£
(õ£°·¼ü)ŌŚĪŽėļüĆø×÷ÓĆĻĀµÄĖ®½āæÉŗöĀŌ”£
(1)H2C(COOH)2µÄ»ÆѧĆū³ĘĪŖ___________”£
(2)¢ŁµÄ·“Ó¦ĄąŠĶŹĒ___________”£
(3)·“Ó¦¢ŚĖłŠčŹŌ¼ĮĢõ¼ž·Ö±šĪŖ___________”¢___________”£
(4)Ąū“±“(V)µÄ·Ö×ÓŹ½ĪŖ___________”£
(5)¢óÖŠ¹ŁÄÜĶŵÄĆū³ĘŹĒ______________________”£
(6)Š“³öÓėĻćĄ¼Č©»„ĪŖĶ¬·ÖŅģ¹¹ĢåµÄõ„Ąą»ÆŗĻĪļµÄ½į¹¹¼ņŹ½(ĒŅŗĖ“Ź²ÕńĒāĘ×ĪŖĖÄ×é·å£¬·åĆ껿֮±ČĪŖ1£ŗ2£ŗ2£ŗ3)£ŗ____________________________________________(Š“³ö3ÖÖ)”£
(7)ŅŃÖŖ£ŗ![]() £¬½įŗĻÉĻŹöĮ÷³ĢÖŠµÄŠÅĻ¢£¬Éč¼ĘŅŌ¼×±½ŗĶ¼×“¼ĪŖĘšŹ¼ŌĮĻÖʱøĮŚ°±»ł±½¼×Ėį¼×õ„(
£¬½įŗĻÉĻŹöĮ÷³ĢÖŠµÄŠÅĻ¢£¬Éč¼ĘŅŌ¼×±½ŗĶ¼×“¼ĪŖĘšŹ¼ŌĮĻÖʱøĮŚ°±»ł±½¼×Ėį¼×õ„(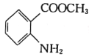 )µÄŗĻ³ÉĀ·Ļß(ĘäĖūĪŽ»śŹŌ¼ĮČĪŃ”)£ŗ__________________________________________________________________”£
)µÄŗĻ³ÉĀ·Ļß(ĘäĖūĪŽ»śŹŌ¼ĮČĪŃ”)£ŗ__________________________________________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠ½šŹōµ„ÖŹAŗĶĘųĢå¼×”¢ŅŅ”¢±ū¼°ĪļÖŹB”¢C”¢D”¢E”¢F”¢G£¬ĖüĆĒÖ®¼äÄÜ·¢ÉśČēĻĀ·“Ó¦(Ķ¼ÖŠÓŠŠ©·“Ó¦µÄ²śĪļŗĶ·“Ó¦µÄĢõ¼žĆ»ÓŠČ«²æ±ź³ö)”£

Ēėøł¾ŻŅŌÉĻŠÅĻ¢»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŹµŃéŹŅÖĘČ”ĀČĘųµÄ»Æѧ·½³ĢŹ½ĪŖ4HCl(ÅØ)+MnO2![]() Cl2”ü+MnCl2+2H2O£¬MnO2×ö______¼Į£¬Čē¹ū·“Ó¦²śÉśµÄĘųĢåŌŚ±źæöĻĀĢå»żĪŖ2.24L£¬Ōņ±»Ńõ»ÆµÄHClµÄĪļÖŹµÄĮæŹĒ_____mol
Cl2”ü+MnCl2+2H2O£¬MnO2×ö______¼Į£¬Čē¹ū·“Ó¦²śÉśµÄĘųĢåŌŚ±źæöĻĀĢå»żĪŖ2.24L£¬Ōņ±»Ńõ»ÆµÄHClµÄĪļÖŹµÄĮæŹĒ_____mol
£Ø2£©Š“³öĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ
¢Ł½šŹōAŗĶĖ®__________________________________________”£
¢ŚĪļÖŹBŗĶĘųĢåŅŅ_______________________________________”£
£Ø3£©ÓĆĮ½øö»Æѧ·½³ĢŹ½±ķŹ¾¹ĢĢåGæÉ×öŗōĪüĻµĶ³¹©Ńõ¼ĮŌŅņ_______________________”£
£Ø4£©ÓĆ»Æѧ·½³ĢŹ½½āŹĶF³¤ĘŚ·ÅÖĆŌŚæÕĘųÖŠŹ§Š§µÄŌŅņ___________________________”£
£Ø5£©ŗģČČĻøĢśĖæÄÜŌŚĘųĢåŅŅ¾ēĮŅČ¼ÉÕ£¬ĻÖĻóŹĒ____________________£¬½«Č¼ÉÕ²śĪļÅä³É±„ŗĶČÜŅŗµĪČė·ŠĖ®ÖŠæÉŅŌµĆµ½µÄĒāŃõ»ÆĢś½ŗĢ壬øĆĒāŃõ»ÆĢś½ŗĢåĮ£×ÓÖ±¾¶ŌŚ_________Ö®¼ä”£ĻņĒāŃõ»ÆĢś½ŗĢåÖŠµĪČė¹żĮæĻ”ĮņĖį£¬ĻÖĻóŹĒ__________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ(””””)
A. ŅŗäåŅ×»Ó·¢£¬ŌŚ“ę·ÅŅŗäåµÄŹŌ¼ĮĘæÖŠÓ¦¼ÓĖ®·ā
B. ÄÜŹ¹ČóŹŖµÄµķ·ŪKIŹŌÖ½±ä³ÉĄ¶É«µÄĪļÖŹŅ»¶ØŹĒCl2
C. ijČÜŅŗ¼ÓČėCCl4£¬CCl4²ćĻŌ×ĻÉ«£¬Ö¤Ć÷ŌČÜŅŗÖŠ“ęŌŚI£
D. ijČÜŅŗ¼ÓČėBaCl2ČÜŅŗ£¬²śÉś²»ČÜÓŚĻ”ĻõĖįµÄ°×É«³Įµķ£¬øĆČÜŅŗŅ»¶Øŗ¬ÓŠAg£«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖ½« 2 mol ĘųĢåA Óė 1 mol ĘųĢåB ³äČėŅ»øöĢå»ż²»±äµÄČŻĘ÷ÄŚ£¬·¢Éś·“Ó¦£ŗ2A+B C+3D+4E£¬“ļµ½Ę½ŗāŗóĘųĢåA µÄÅØ¶Č¼õÉŁŅ»°ė£¬·¢ĻÖÓŠŅŗĢåÉś³É£¬ŌŚĻąĶ¬µÄĪĀ¶ČĻĀ²āµĆ·“Ó¦ Ē°ŗóŃ¹Ēæ·Ö±šĪŖ 6.06”Į106 Pa ŗĶ 8.08”Į106 Pa£¬ÓÖ²āµĆ·“Ó¦¹²·Å³öČČĮæ Q kJ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )
A. øĆ·“Ó¦ŌŚČĪŗĪĪĀ¶ČĻĀ¶¼æÉ×Ō·¢½ųŠŠ
B. ŌŚÉĻŹöĘ½ŗāĢåĻµÖŠŌŁ¼ÓČė 1 mol A ŗĶ 0.5 mol B£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬A µÄ×Ŗ»ÆĀŹŌö“ó
C. øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ 2A(g)+B(g) C(g)+3D(l)+4E(g) ¦¤H= -Q kJ/mol
D. ÉĻŹö·“Ó¦“ļµ½Ę½ŗāŗó£¬ĘäĖūµÄĢõ¼ž²»±äµÄĒéæöĻĀ£¬ÉżøßĪĀ¶Č£¬Ń¹ĒæŅ»¶ØŌö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖŅ»¶ØĢõ¼žĻĀĻõĖįļ§ŹÜČČ·Ö½āµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ5NH4NO3![]() 2HNO3£«4N2”ü£«9H2O£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
2HNO3£«4N2”ü£«9H2O£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
A. ·Ö½ā·“Ó¦¶¼ŹĒŃõ»Æ»¹Ō·“Ó¦B. N2ŹĒ»¹Ō²śĪļ£¬HNO3ŹĒŃõ»Æ²śĪļ
C. ±»Ńõ»ÆÓė±»»¹ŌµÄµŖŌ×ÓŹżÖ®±ČĪŖ3”Ć5D. ĆæÉś³É4mol N2×ŖŅĘ15molµē×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ2NaHCO3![]() Na2CO3 + H2O+CO2 £¬ĻÖ°Ń14.8g Na2CO310H2OŗĶNaHCO3×é³ÉµÄ¹ĢĢå»ģŗĻĪļČÜÓŚĖ®Åä³É100mLČÜŅŗ£¬ĘäÖŠc£ØNa+£©=1.2molL©1£¬Čō°ŃµČÖŹĮæµÄ¹ĢĢå»ģŗĻĪļ¼ÓČČÖĮŗćÖŲ£¬²ŠĮō¹ĢĢåÖŹĮæŹĒ£Ø”” £©
Na2CO3 + H2O+CO2 £¬ĻÖ°Ń14.8g Na2CO310H2OŗĶNaHCO3×é³ÉµÄ¹ĢĢå»ģŗĻĪļČÜÓŚĖ®Åä³É100mLČÜŅŗ£¬ĘäÖŠc£ØNa+£©=1.2molL©1£¬Čō°ŃµČÖŹĮæµÄ¹ĢĢå»ģŗĻĪļ¼ÓČČÖĮŗćÖŲ£¬²ŠĮō¹ĢĢåÖŹĮæŹĒ£Ø”” £©
A. 6.36gB. 3.18gC. 4.22gD. 5.28g
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com