
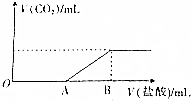
 标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得所得溶液M的pH>7(反应前后溶液的体积变化忽略不计),在溶液M中逐滴缓慢滴加1mol•L-1 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示,已知图中B点的位置固定,V(B)=300mL,而A点可在横坐标中自由移动.
标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得所得溶液M的pH>7(反应前后溶液的体积变化忽略不计),在溶液M中逐滴缓慢滴加1mol•L-1 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示,已知图中B点的位置固定,V(B)=300mL,而A点可在横坐标中自由移动.分析 过程中发生的反应:2NaOH+CO2═Na2CO3+H2O、NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,则n(HCl)=n(NaCl),并根据反应的化学方程式求出B点时生成的氯化钠的物质的量,然后求出其溶液中物质的量浓度即可.
解答 解:(1)300mL=0.3L,100mL=0.1L,过程中发生的反应:2NaOH+CO2═Na2CO3+H2O、NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O;由A点到B点发生的离子方程式为Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,
故答案为:Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O;
(2)由此可以的关系式为:NaOH-HCl-NaCl,反应过程中消耗盐酸的物质的量为1mol/L×0.3L=0.3mol,由原子守恒可知,n(NaOH)=n(NaCl)=n(HCl)=0.3mol,则原NaOH溶液的物质的量浓度为:$\frac{0.3mol}{0.1L}$=3mol/L,故答案为:3.
点评 本题考查化学反应的计算,题目难度较大,把握图象分析与各阶段发生的化学反应的对应关系为解答的关键,侧重分析能力和计算能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | c(X2)=0.15mol/L | B. | c(Y2)=0.9mol/L | C. | c(Z2)=0.3mol/L | D. | c(Q2)=0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3溶解于水时能导电,所以SO3是电解质 | |
| B. | 离子化合物中不存在独立的分子 | |
| C. | 稀硝酸能导电,所以HNO3溶液属于电解质 | |
| D. | 熔融时能导电的物质一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO燃烧的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=+285.8kJ/mol | |
| B. | H2燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol | |
| C. | 燃烧前混合气体中H2的体积分数为40% | |
| D. | 燃烧后的产物全部与足量的过氧化钠作用可产生1.25mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 构成氨基酸的元素只有C、H、O、N4种 | |
| B. | 氨基酸丙和丁的R基分别是-NH3和-CH2-COOH | |
| C. | R基中可以有氨基或羧基 | |
| D. | 组成水稻的氨基酸包括必需氨基酸和非必需氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有④ | B. | 只有⑤ | C. | ①②③④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则b表示有催化剂的情况 | |
| B. | 若乙图中a曲线表示200℃、b曲线表示100℃时的情况,则反应的正反应是放热反应 | |
| C. | 若丙图中两条曲线分别表示不同压强下的情况,则b曲线是表示压强较大的情况 | |
| D. | 若丙图中两条曲线分别表示不同温度下的情况,则a曲线是表示温度较大的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢,并采用新一代的氮化镓铟高亮度LED材料.下列有关说法正确的是( )
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢,并采用新一代的氮化镓铟高亮度LED材料.下列有关说法正确的是( )| A. | 合金的熔点通常比组分金属高,硬度比组分金属小 | |
| B. | 已知Ga处于ⅢA族,可推知氮化镓化学式为Ga3N2 | |
| C. | 用金属铝与V2O5冶炼钒,铝作还原剂 | |
| D. | 合金的化学性质一般与其各成分金属的化学性质不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com