
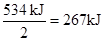 。生成物1mol气态水生成液态时,放出的热量是44kJ,所以16 g气态肼燃烧生成氮气和液态水时,放出的热量是267kJ+44kJ=311 kJ。
。生成物1mol气态水生成液态时,放出的热量是44kJ,所以16 g气态肼燃烧生成氮气和液态水时,放出的热量是267kJ+44kJ=311 kJ。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2 (g)
O2 (g) | A.– 283.01 kJ · mol – 1 | B.+ 172.51 kJ · mol –1 |
| C.+ 283.01 kJ · mol – 1 | D.+ 504.00 kJ · mol – 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S(g)+O2(g)===SO2(g) ΔH=a;S(s)+O2(g)===SO2(g) ΔH=b;则a>b |
| B.C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ/mol,则可判定石墨比金刚石稳定 |
| C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的溶液与稀盐酸完全反应,放出的热量为28.7 kJ |
| D.CaCO3(s)===CaO(s)+CO2(g) ΔH>0,则该反应任何温度下都能自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.H2(g) +  O2(g) ="=" H2O(l);△H= —142.9kJ/mol O2(g) ="=" H2O(l);△H= —142.9kJ/mol |
| B.2H2(g) + O2(g) ="=" 2H2O(l);△H= 571.6kJ/mol |
| C.2H2(g) + O2(g) ="=" 2H2O(l);△H= —571.6kJ/mol |
| D.2H2 + O2 ="=" 2H2O;△H= —571.6kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳的燃烧热大于110.5kJ/mol |
| B.①的反应热为221kJ/mol |
| C.稀硫酸与稀KOH溶液反应的中和热为-57.3kJ/mol |
| D.稀硫酸与NaOH固体反应生成1mol水的焓变大于ΔH2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
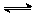 2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )| A.Q1 <1/2Q | B.Q1 = 1/2Q | C.2Q1 > Q | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放出的热量为(0.4Q1+0.05Q3)KJ | B.放出的热量为(0.4Q1+0.05Q2)KJ |
| C.△H2 = △H3 | D.△H2 <△H3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3的能量变化如图所示,写出生成氨气时该反应的热化学方程式 。
2NH3的能量变化如图所示,写出生成氨气时该反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com