
分析 淀粉为多糖,水解生成葡萄糖,葡萄糖在酶的催化作用下分解生成乙醇和二氧化碳,乙醇催化氧化生成乙醛,乙醛氧化生成乙酸,淀粉遇到淀粉变蓝色,据此解答.
解答 解:(1)淀粉为多糖,淀粉在稀硫酸作用下水解生成葡萄糖,水解的方程式为(C6H10O5)n+nH2O$\stackrel{稀硫酸}{→}$nC6H12O6,
故答案为:(C6H10O5)n+nH2O$\stackrel{稀硫酸}{→}$nC6H12O6;
(3)乙醇在铜或银做催化剂条件下发生催化氧化生成乙醛和水,
反应的方程式为2CH3CH2OH+O2$→_{△}^{Ag或者Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Ag或者Cu}$2CH3CHO+2H2O;
(4)淀粉的特性是淀粉遇碘液变蓝色,因此可以用碘液来检验食醋中是否含有淀粉,若碘液变蓝色,说明含有淀粉;
故答案为:用碘液来检验食醋中是否含有淀粉,若碘液变蓝色,说明含有淀粉.
点评 本题考查了化学方程式的书写,物质的检验,明确淀粉、葡萄糖、乙醇、乙醛的性质是解题关键,注意淀粉的特性及检验方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
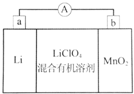 锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池负极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 该电池电解液可用LiClO4水溶液代替 | |
| D. | 从废旧锂锰电池的正极材料中可回收金属Li、Mn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液中溶质质量分数 | 4% | 12% | 16% | 24% | 28% |
| 硫酸溶液的密度/(克/厘米3) | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/(克/厘米3) | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10 | B. | C3H8 | C. | C2H6 | D. | CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤②④①③ | B. | ④①②⑤③ | C. | ①④②⑤③ | D. | ②④⑤①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数c>d | B. | 离子的还原性Y2->Z- | ||
| C. | 离子半径aW3+>cY2- | D. | 原子半径X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Al | B | Be | C | Cl | F | Li |
| x的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| x的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com