
【题目】![]() 与
与![]() 催化重整反应为
催化重整反应为![]()
![]() 。现向
。现向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 进行催化重整反应,不同温度下平衡体系中
进行催化重整反应,不同温度下平衡体系中![]() 和CO的体积分数
和CO的体积分数![]() 随温度变化如下表所示:
随温度变化如下表所示:
体积分数 温度 |
|
|
| a | a |
| c | b |
测得:![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
A.![]() 大于
大于![]()
B.![]() 时该反应的平衡常数为
时该反应的平衡常数为![]()
C.![]() 时向
时向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 进行催化重整反应,达到平衡时,
进行催化重整反应,达到平衡时,![]() 为
为![]()
D.![]() 时向
时向![]() 恒容密闭容器中充入等物质的量
恒容密闭容器中充入等物质的量![]() 、
、![]() 、CO、
、CO、![]() 进行催化重整反应,此时反应可能正向移动
进行催化重整反应,此时反应可能正向移动
【答案】D
【解析】
A.由![]() 可知,平衡向正向移动,而该反应为吸热反应,则
可知,平衡向正向移动,而该反应为吸热反应,则![]() 到
到![]() 为温度升高,故
为温度升高,故![]() 小于
小于![]() ,故A错误;
,故A错误;
B.假设![]() 平衡时一氧化碳的浓度为
平衡时一氧化碳的浓度为![]() ,则:
,则:
由 ![]() 单位:
单位:![]()
初始浓度: ![]()
![]() 0 0
0 0
平衡浓度: ![]()
![]() 2x 2x
2x 2x
变化浓度: x x 2x 2x
由甲烷与一氧化碳的体积分数相等,可得:![]() ,
,
解得![]() ,故该温度下的平衡常数为:
,故该温度下的平衡常数为:![]() ,故B错误;
,故B错误;
C.![]() 时向
时向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 进行催化重整反应,即初始浓度等比例减半,若平衡不移动,则
进行催化重整反应,即初始浓度等比例减半,若平衡不移动,则![]() 仍为a,而此时与原平衡相比,此时则反应相当于压强减小,平衡向正向移动,则达到平衡时,
仍为a,而此时与原平衡相比,此时则反应相当于压强减小,平衡向正向移动,则达到平衡时,![]() 大于a,故C错误;
大于a,故C错误;
D.![]() 时向
时向![]() 恒容密闭容器中充入等物质的量
恒容密闭容器中充入等物质的量![]() 、
、![]() 、CO、
、CO、![]() 进行催化重整反应,假设均为
进行催化重整反应,假设均为![]() ,则浓度熵
,则浓度熵![]() ,若
,若![]() 时,反应正向移动,若
时,反应正向移动,若![]() 时,反应不移动,若
时,反应不移动,若![]() 时,反应逆向移动,故可能向正向移动,故D正确;
时,反应逆向移动,故可能向正向移动,故D正确;
故答案选D。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是( )

A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取增大反应体系压强的措施
D. 若图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题。
(1)基态氮原子的价电子排布图为________________。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ 键的数目为_____________。
②与CNO—互为等电子体的分子为_____________。(任写一种,填化学式)
(3)往CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子,已知NF3和NH3的空间构型都是三角锥型,但NF3不易与Cu2+形成配合离子,其原因是_______。
(4)分子中的大 π键可用符合 πmn 表示,其中m表示形成大 π 键的原子数,n表示参与形成大 π 键的电子数(如苯分子中的大 π键可表示为π66)。则NO3-中的大 π键应表示为________________。
(5)多硼酸根的结构之一为链状(如图),其化学式为____________。

(6)氮化硼晶体有多种结构,其中立方氮化硼具有金刚石的结构(如图)。若晶胞边长为a nm,晶胞中N原子位于B原子所形成的正四面体的体心,则B—N键的键长为____nm,这种氮化硼晶体的密度为______g/cm3 。(用含有a和NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾( K2FeO4)不仅是一种理想的水处理剂(胶体),而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
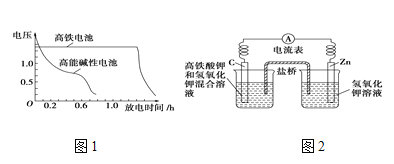
①该电池放电时正极的电极反应式为____________________________________;
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向________(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向______(填“左”或“右”)移动。
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有_____________________________________________________________。
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是____________________,A是____________。
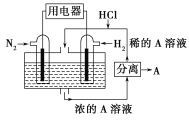
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为___________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 的密闭容器中,放入镍粉并充入
的密闭容器中,放入镍粉并充入![]() 定量的CO气体,一定条件下发生反应:
定量的CO气体,一定条件下发生反应:![]() ,已知该反应平衡常数与温度的关系如表所示:下列说法正确的是
,已知该反应平衡常数与温度的关系如表所示:下列说法正确的是![]()
![]()
温度 | 25 | 80 | 230 |
平衡常数 |
| 2 |
|
A.上述生成Ni![]()
![]() 的反应为吸热反应
的反应为吸热反应
B.![]() 时反应Ni
时反应Ni![]()
![]() 的平衡常数为
的平衡常数为![]()
C.在![]() 时,测得某时刻,
时,测得某时刻,![]() 、CO浓度均
、CO浓度均![]()
![]() ,则此时
,则此时![]()
D.![]() 达到平衡时,测得
达到平衡时,测得![]() 3mol,则
3mol,则![]() 的平衡浓度为2
的平衡浓度为2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向容积为2L的恒容密闭容器中充入一定量的CO和
时,向容积为2L的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() 。反应过程中测定的部分数据见下表:
。反应过程中测定的部分数据见下表:
反应时间 |
|
|
0 |
|
|
20 |
|
|
30 |
|
|
下列说法正确的是
A.反应在![]() 内的平均速率为
内的平均速率为![]()
B.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() 、
、![]() 、
、![]() ,达到新平衡前
,达到新平衡前![]() 正
正![]() 逆
逆![]()
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是( )
A.0.2 mo1CO2通入1L 0.3molL-1 KOH溶液中:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-)
B.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.常温下pH=4.75、浓度均为0.1mol/L 的CH3COOH、CH3COONa 混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
D.已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如图:
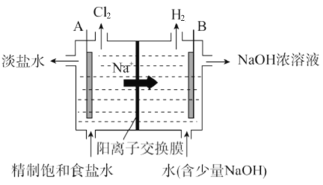
(1)电极 A 是_________(填“阴极”或“阳极”),判断依据为_________。
(2)写出电极 B 的电极反应式_________。
(3)写出电解饱和食盐水的化学方程式_________。
(4)一段时间后,电极 B 周围 NaOH 稀溶液转变为浓溶液,原因:_________。
(5)电解时,工业用盐酸调节 A 室的 pH=2~3,请用化学平衡原理解释原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2 与N2 在催化剂表面生成 NH3,反应历程及能量变化示意如下。

下列说法不正确的是
A.①→②吸收能量
B.②→③形成了N-H 键
C.该催化剂可提高NH3 的平衡产率
D.该反应为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com