


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、蛋白质、棉花、核酸、PVC、淀粉都是由高分子组成的物质 |
| B、合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
| C、红外光谱仪、核磁共振、质谱仪、分光光度计都可用于有机化合物官能团结构的分析 |
| D、造成大气污染的SO2、CO和NO,主要来源于化石燃料的燃烧和汽车尾气的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
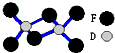 短周期元素A、B、C、D、E、F的原子序数依次增大,A与E、B与F属于同一主族,且A与E可以形成某种化合物X,其中A的质量分数为50%;C、D、F最高价氧化物对应的水化物两两之间都能反应,且C、D、F原子最外层电子数之和等于C的原子序数.则下列说法正确的是( )
短周期元素A、B、C、D、E、F的原子序数依次增大,A与E、B与F属于同一主族,且A与E可以形成某种化合物X,其中A的质量分数为50%;C、D、F最高价氧化物对应的水化物两两之间都能反应,且C、D、F原子最外层电子数之和等于C的原子序数.则下列说法正确的是( )| A、D、F两种元素能形成如图所示的二聚分子,则该化合物的化学式是D2F6,为离子化合物,在熔融状态下能导电 |
| B、B、F两元素形成的氢化物稳定性中,B的氢化物比较稳定,其原因为其分子间存在氢键 |
| C、将标况下22.4L的X加入到足量的水中,完全吸收后得1mol的对应的酸 |
| D、用电解法可制得C、D、F的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 编号 | 常温下反应 | 化学平衡常数 |
| 反应甲 | Au+6HNO3?Au(NO3)3+3NO2↑+3H2O | <10-5 |
| 反应乙 | Au3++4Cl-?[AuCl4]- | >105 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某些金属化合物具有特定的颜色,因此可制作烟花 |
| B、H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化学反应过程中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量 |
| B、甲烷的燃烧热△H=-890kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ?mol-1 |
| C、已知常温常压下:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,则有:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ?mol-1 |
| D、已知:S(s)+O2(g)=SO2(g)△H1=-Q1 kJ?mol-1,S(g)+O2(g)=SO2(g)△H2=-Q2kJ?mol-1,则Q1<Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气与氯气见光发生爆炸,说明氢气与氯气具有的总能量小于氯化氢 |
| B、浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色物质生成且能溶于浓硝酸 |
| C、由于碳燃烧时放出大量的热,所以碳与氧气的反应不需要任何条件 |
| D、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com