
| A. | 任何酸与碱反应生成1 mol H2O的过程中,放出的热量均相同 | |
| B. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| C. | 光照时,H2(g)+Cl2(g)═2HCl(g)△H=aKJ/mol;若反应条件变为点燃,△H将减少 | |
| D. | 表示碳燃烧热的热化学方程式为:2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1 |
分析 A.弱酸与弱碱在溶液中主要以分子形式存在,电离吸热;
B.等质量的同种物质,气态时具有的能量高;
C.反应热与反应条件无关;
D.燃烧热是指1mol物质完全燃烧生成最稳定的氧化物所放出的热量.
解答 解:A、弱酸与弱碱在溶液中主要以分子形式存在,由于电离吸热,生成1mol液态水放出的热量小于57.3kJ,故A错误;
B.等质量的同种物质,气态时具有的能量高,所以硫蒸汽的能量大于硫固体的能量,因此,等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,故B正确;
C.反应热与反应条件无关,只与反应物的始态和终态有关,所以光照时,H2(g)+Cl2(g)═2HCl(g)△H=aKJ/mol;若反应条件变为点燃,△H将不变,故C错误;
D.燃烧热是指1mol物质完全燃烧生成最稳定的氧化物所放出的热量,热化学方程式中CO的计量数应该为1,故D错误.
故选B.
点评 本题考查学生燃烧热的概念以及盖斯定律的应用,注意知识的积累和应用是关键,题目难度不大,侧重于考查学生的分析能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④⑤ | C. | ①③⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
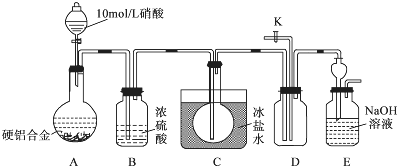
| 金属离子 | 开始沉淀时的pH | 沉淀完全的pH |
| Al3+ | 3.4 | 4.7 |
| Cu2+ | 4.1 | 6.9 |
| Mg2+ | 9.4 | 12.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量水,水的电离平衡向正方向移动 | |
| B. | 加入少量NaHCO3固体,c(ClO-)减小 | |
| C. | 通入少量SO2,溶液漂白性增强 | |
| D. | 加入NaOH固体至溶液呈中性时,c(Na+)═c(Cl-)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| B. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| C. | 制乙炔时,用排水法或向上排空气法收集气体 | |
| D. | 制一氧化氮时,用排空气法收集气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
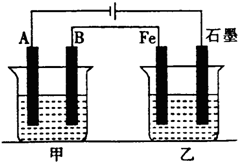 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com