
(16分)实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。回答以下问题:
⑴化学小组主要选用了下列药品和仪器进行实验。(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)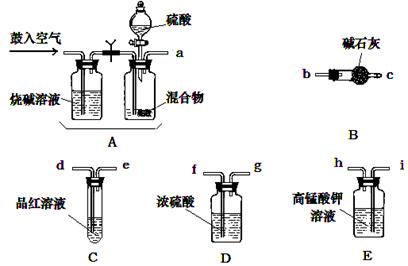
请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b...)
a→ → → → → f →g → → 。
⑵实验开始,混合物加酸前,A装置需要鼓入空气,作用是 ;加酸后A装置再次鼓入空气的作用是 。
⑶ E装置的作用是 。
⑷实验中,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”)。为了确
保实验中C瓶溶液不褪色,若取样品的质量为m g,实验前 E中所装 a mol·L-1的KMnO4
溶液体积(V)不少于 mL。
⑸若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质
量分数为 。
⑹从定量测定的准确性考虑,该套装置还应作进一步的改进是 。
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32
⑴ a→i→h→d→e→f→g→b→c
⑵排出装置中原有空气,将生成的气体全部送入后续装置(答使反应产生的CO2
和SO2能被完全吸收也对)
⑶除去SO2,以防止SO2对测定结果的影响
⑷高 50m/(13a)
⑸ 60.3%
⑹在B之后再接一个阻止空气中水和二氧化碳进入B的装置
解析试题分析:(1)本题实验原理是向混合物中加酸产生二氧化碳和二氧化硫气体,用高锰酸钾溶液除去二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,将气体通过浓硫酸干燥,最后用碱石灰吸收二氧化碳气体,碱石灰增加的质量即为二氧化碳气体的质量。所以装置连接顺序是aihdefgbc。。
(2)实验开始,混合物加酸前,A装置需要鼓入空气目的是排出系统中的二氧化碳气体,加酸后再次鼓入空气的作用是使生成的气体全部进入后续装置。
(3)高锰酸钾溶液的作用是吸收二氧化硫气体。
(4)若品红溶液褪色,说明二氧化硫气体没有除尽,所以碱石灰质量将偏大,测定结果将偏高。根据得失电子相等得二氧化硫与高锰酸钾关系为5SO2~2KMnO4。若mg固体全是亚硫酸氢钠,则生成二氧化硫m/104mol,需要高锰酸钾物质的量为m/260mol,所以高锰酸钾溶液体积不少于50m/13amL。
(5)碱石灰增重4.4g,二氧化碳物质的量为0.1mol,由碳元素守恒,碳酸氢铵物质的量也为0.1mol,碳酸氢铵质量为7.9g,所以碳酸氢铵质量分数为60.3%。
(6)碱石灰与大气相通,碱石灰能吸收空气中的二氧化碳和水蒸气,所以应在碱石灰后面再连接一个装有碱石灰的装置。
考点:化学实验
点评:本题主要目的是测定二氧化碳气体的质量,但二氧化硫也能被碱石灰吸收,所以在吸收二氧化碳气体前应将二氧化硫气体除尽,除去二氧化硫气体一般用酸性高锰酸钾溶液或溴水,再用品红溶液检验二氧化硫气体是否除尽。


科目:高中化学 来源: 题型:阅读理解

| 50m |
| 13a |
| 50m |
| 13a |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012届河南省信阳市高中毕业班第一次调研考试化学试卷 题型:实验题
(16分)实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某化学兴趣小组测定其中NH4HCO3的含量。小组的同学设计用在混合 物中加酸的实验方法来测定其中NH4HCO3的质量分数。(SO2与酸性KMnO4的反应原理:SO2+MnO4-+H+-->SO42-+Mn2++H2O )
物中加酸的实验方法来测定其中NH4HCO3的质量分数。(SO2与酸性KMnO4的反应原理:SO2+MnO4-+H+-->SO42-+Mn2++H2O )
回答以下问题:
(1)化学小组主要选用了下列药品和仪器进行实验(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)
请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b...)
A→ → → → → f → g → →
(2)实验开始,混合物加酸前,A装置需要鼓入空气,作用是 ;加酸后A装置再次鼓入空气的作用是 。
(3)E 装置的作用是: 。
(4)实验中,若D瓶中溶液褪色,则测定结果可能会偏 ,为了确保实验中D瓶溶液不褪色,若取样品的质量为m g,实验前 E中所装 a mol ·L-1的KMnO4溶液体积(V)不少于 _____________mL;
·L-1的KMnO4溶液体积(V)不少于 _____________mL;
(5)若混合物样品质量为13.1 g,充分作用后碱石灰增重4.4 g,则混合物中NH4HCO3的质量分数为  。
。
(6)从定量测定的准确性考虑,该套装置还应作进一步的改进是
_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届山西省高二下学期期中考试化学试卷(解析版) 题型:填空题
实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。化学小组主要选用了下列药品和仪器进行实验(铁架台等固定仪器未画出)。按气流由左向右的方向,仪器连接顺序是 。回答以下问题:
。回答以下问题:

(1)A中加入硫酸溶液的仪器名称是: 。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,排除装置中原有的空气。加酸后A装置再次鼓入空气的作用是 。
(3)E装置的作用是 。
(4)实验中,要确保实验中C瓶溶液不褪色,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”)。
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为 。
(6)从定量测定的准确性考虑,该套装置还应作进一步的改进是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高三上学期期中考试化学试卷(解析版) 题型:实验题
(16分)实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。回答以下问题:
⑴ 化学小组主要选用了下列药品和仪器进行实验。(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)

请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b...)
a→ → → → → f →g → → 。
⑵ 实验开始,混合物加酸前,A装置需要鼓入空气,作用是 ;加酸后A装置再次鼓入空气的作用是 。
⑶ E装置的作用是 。
⑷ 实验中,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”)。为了确
保实验中C瓶溶液不褪色,若取样品的质量为m g,实验前 E中所装 a mol·L-1的KMnO4
溶液体积(V)不少于 mL。
⑸ 若混合物样品质量为13.1 g,充分作用后碱石灰增重4.4 g,则混合物中NH4HCO3的质
量分数为 。
⑹ 从定量测定的准确性考虑,该套装置还应作进一步的改进是 。
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com