
【题目】如图所示,将铁、铜通过导线相连,置于稀硫酸中. 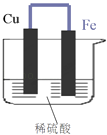
(1)铁片为极,其电极反应式 .
(2)铜片上的现象是 , 其发生的反应的类型是反应.(填“氧化”或“还原”)
(3)若导线中通过了0.6mol电子,Fe的质量理论上减少克.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的N2和C2H4 D. 压强相同、体积相同的N2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?),t1时刻达到平衡,t2时刻缩小容器体积,t3时刻再次达到平衡后未再改变条件,如图所示。下列说法正确的是
X(g)+Y(?),t1时刻达到平衡,t2时刻缩小容器体积,t3时刻再次达到平衡后未再改变条件,如图所示。下列说法正确的是

A. Z和W在该条件下至少有一种为气态
B. t1~ t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~ t2时间段与t3时刻后的X浓度不相等
D. 若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 红棕色NO2加压后颜色先变深后变浅
B. 实验室中常用排饱和食盐水的方法收集氯气
C. SO2催化氧化成SO3的反应,使用过量的空气以提高二氧化硫的利用率
D. 压缩H2与I2(g)反应的平衡混合气体,颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1=―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H2=―Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H3=―Q3 kJ/mol
(Q1,Q2,Q3>0)下列判断正确的是
A. △H1>△H2>△H3 B. Q1>Q3>Q2
C. △H1<△H2<△H3 D. Q2>Q1>Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2A(g)+B(g)![]() 2C(g);ΔH =-a kJ/mol(a>0)。在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500℃时充分反应达平衡后C的浓度w mol/L,放出热量b kJ。
2C(g);ΔH =-a kJ/mol(a>0)。在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500℃时充分反应达平衡后C的浓度w mol/L,放出热量b kJ。
(1)比较a____b(填“>”“=”或“<”)。
(2)若在原来的容器中,只加入2 mol C,500℃ 时充分反应达到平衡后,吸收热量c kJ,C浓度__________w mol/L(填“>”“=”或“<”),a、b、c之间满足何种关系_______________(用a、b、c建立一个等式关系)。
(3)能说明该反应已经达到平衡状态的是____________(填写字母)。
A.v(C)=2v(B) B.容器内压强保持不变
C.v逆(A)=2v正(B) D.容器内的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的操作是_______(填写字母)。
A.及时分离出C气体 B.适当升高温度
C.增大B的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积、压强相同),起始时加入2 mol A和1 mol B,500℃时充分反应达平衡后,放出热量d kJ ,则d________b(填“>”、“=”或“<”),理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提纯下列物质(括号中为杂质),选择试剂和分离方法都正确的是( )
选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
B | 蔗糖(葡萄糖) | 水 | 过滤 |
C | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
D | 苯(碘) | 水 | 过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
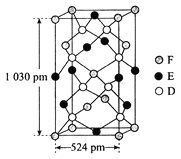
【题目】已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A、C原子的L能层中都有两对未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对的电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号________,该能层具有的原子轨道数为_________。
(2)E2+离子的价层电子排布图是__________,F原子的电子排布式是__________。
(3)A元素的最高价氧化物对应的水化物中心原子采用的轨道杂化方式为______,B元素的气态氢化物的VSEPR模型为___________。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们的结构相似,DAB-的电子式为_____________
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为________________________
(6)某种化合物由D、E、F三种元素组成,其晶胞如图所示,其化学式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com