
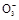
 BaCO3↓+H2O)
BaCO3↓+H2O)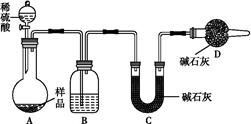
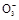 、C
、C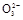 离子,现象明显的是用S
离子,现象明显的是用S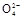 鉴别Ba2+。
鉴别Ba2+。

科目:高中化学 来源:不详 题型:单选题
| A.溶液中Na+离子个数为NA(NA表示阿伏加德罗常数) |
| B.溶液中的CO32—离子浓度先增大后减小 |
| C.微热反应后的溶液,溶液的pH会升高 |
| D.当恰好生成Na2CO3时,溶液中离子浓度大小存在以下关系: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.③④ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
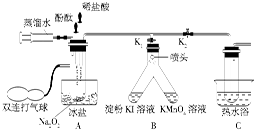
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
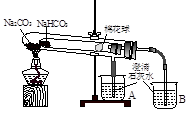
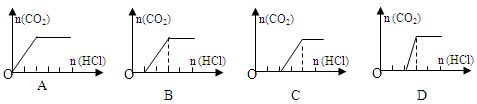
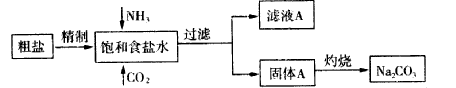
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色 |
| B.1 mol Na2O2与H2O完全反应,转移2 mol电子 |
| C.充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3 |
| D.a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
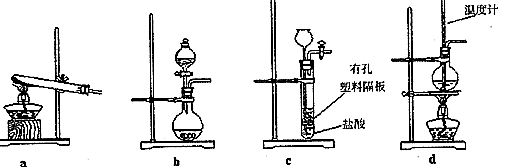
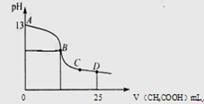
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
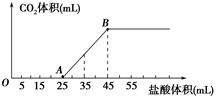
| A.OA段发生反应的离子方程式为H++OH-=H2O CO32-+H+=HCO3- |
| B.A点溶液中的溶质为NaC1、NaHCO3 |
| C.混合物中NaOH的质量0.6g |
| D.当加入35mL盐酸时,产生CO2的体积为336mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com