
【题目】将贮满某种干燥气体的试管倒置于水中,轻轻摇晃后,水可以充满试管。该气体可能是
A.O2 B.N2 C.H2 D.NH3
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】标准状况下有:①5.4mL H2O ②5.6L CH4 ③3.01×1023个H2S分子 ④19.6g H2SO4 , 这些物质中,含分子个数由多到少的顺序是( )
A.③①②④
B.③①④②
C.①②③④
D.④②③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1molH2O的质量是18g
B.氮原子的质量就是氮的相对原子质量
C.1molH2SO4中含1molH2
D.氢氧化钠的摩尔质量是40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用木质纤维可合成药物中间体H,还能合成高分子化合物G,合成路线如下:

已知:
①![]() ②
②![]()
(1)A的化学名称是___________________。
(2)B的结构简式是_____________,由C生成D的反应类型为_____________________。
(3)化合物E的官能团为__________________________。
(4)F分子中处于同一平面的原子最多有___________个。F生成G的化学反应方程式为_________________________________。
(5)芳香化合物I为H的同分异构体,苯环上一氯代物有两种结构,1molI发生水解反应消耗2mol NaOH,符合要求的同分异构体有______种,其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:3:2:1的I结构简式为__________________________。
(6)写出用 为原料制备
为原料制备![]() 的合成路线(其他试剂任选)__________。
的合成路线(其他试剂任选)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各装置图的叙述中,不正确的是( )
A.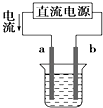 如图装置中a为阳极、b为阴极
如图装置中a为阳极、b为阴极
B.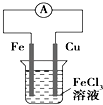 如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+
如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.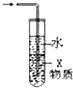 如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D. 如图装置中的铁钉几乎不被腐蚀
如图装置中的铁钉几乎不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、SO42-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是( )
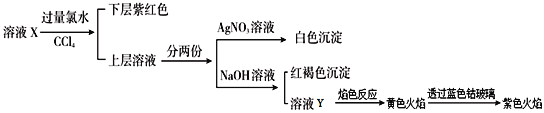
A. 该溶液X中Na+、Cl-一定有
B. 溶液Y中加入氯化钡溶液没有沉淀
C. 该溶液可能是硫酸亚铁、碘化钾和氯化钠溶于水后得到的
D. 原溶液X中滴加几滴KSCN溶液后,再滴加少量的次氯酸钠溶液后溶液呈血红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:

已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有_________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_______________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是____________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是___________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是___________________________________,若用去了30.00mL FeC13溶液,待测钛液中TiOSO4的物质的量浓度是______________mol/L。
【答案】 漏斗、玻璃棒 溶液中存在平衡:TiO2++2H2O![]() H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na
H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na![]() Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色 1.50 mol/L
Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色 1.50 mol/L
【解析】钛铁矿用浓硫酸溶解,浓硫酸具有酸性,强氧化性,反应的主要产物是TiOSO4和FeSO4,还可能有少量Fe2(SO4)3;向所得溶液中加入大量水稀释后,加入过量铁粉还原Fe3+,过滤得到滤液中只含有TiOSO4和FeSO4;TiOSO4水解过滤后得到H2TiO3,H2TiO3加热灼烧得到TiO2,加入Cl2、过量碳高温反应生成TiCl4,TiCl4和Mg高温反应得到MgCl2和Ti。
(1)操作1为过滤,所需玻璃仪器有烧杯、漏斗、玻璃棒,故还缺少的仪器为:漏斗和玻璃棒;故答案为:漏斗、玻璃棒;
(2)TiOSO4遇水会水解,水解方程式为TiO2++2H2OH2TiO3+2H+,水解是吸热过程,加热能促进水解;加水稀释,促进水解。
故答案为:溶液中存在平衡:TiO2++2H2OH2TiO3+2H+,当加入水稀释、升温后,平衡正向移动;
(3)在流程中,金属镁置换出钛单质,反应方程式为:TiCl4+2Mg![]() Ti+2MgCl2。钛的还原性介于铝与锌之间,即还原性:Al>Ti>Zn,又因为还原性Na>Al>Zn>Fe,则Na>Al>Ti>Zn>Fe,故Na、Zn、Fe三种金属中只能选择金属Na代替镁。反应方程式为:TiCl4+4Na
Ti+2MgCl2。钛的还原性介于铝与锌之间,即还原性:Al>Ti>Zn,又因为还原性Na>Al>Zn>Fe,则Na>Al>Ti>Zn>Fe,故Na、Zn、Fe三种金属中只能选择金属Na代替镁。反应方程式为:TiCl4+4Na
![]() Ti+4NaCl。
Ti+4NaCl。
故答案为:TiCl4+4Na![]() Ti+4NaCl;
Ti+4NaCl;
(4)根据题意可知,TiO2作阴极,得电子,被还原得到单质Ti,则阴极电极反应式为:TiO2+4e-=Ti+2O2-。故答案为:TiO2+4e-=Ti+2O2-;
(5)FeC13有强的氧化性,腐蚀橡胶,且其溶液呈酸性,所以选择酸式滴定管。用KSCN溶液作指示剂,TiO2+反应完之前溶液为无色。当反应完,再滴入1滴FeC13溶液,溶液立即变红色,且半分钟后溶液颜色不褪色,到达滴定终点,停止滴定。
滴定过程中消耗n(FeC13)=0.1mol/L×0.03L=0.003mol。根据反应方程式可得出TiOSO4与Fe3+的关系式:TiOSO4~Ti3+~Fe3+,即滴定过程中n(FeC13)= n(TiOSO4)= 0.003mol。原待测液为10mL,稀释至100mL后,取2omL溶液进行滴定实验。所以原10mL待测液中含n(TiOSO4)= 0.003mol×![]() =0.015mol,c(TiOSO4)=
=0.015mol,c(TiOSO4)= ![]() =1.5 molL-1。
=1.5 molL-1。
故答案为:酸式滴定管;溶液由无色变成红色且半分钟不褪色 ;1.5 molL-1.
【题型】综合题
【结束】
11
【题目】Fe3+与CN-、F-、有机分子等形成的化合物具有广泛的应用。
(1)Fe3+基态核外电子排布式为________。
(2)乙酰基二茂铁是常用汽油抗震剂,其结构如图甲所示。此物质中碳原子的杂化方式是__________。
(3)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为__________________。
(5)F-不仅可与Fe3+形成3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,其结构如图乙所示,则该晶体的化学式为__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全燃烧一定量的某有机物,生成88g CO2和27g H2O,下列说法正确的是( )
A. 该有机物的最简式为C2H3 B. 该有机物分子中一定含有碳碳双键
C. 该有机物不可能是乙烯 D. 该有机物一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方铅矿的主要成分为PbS,含铅可达86.6%。以方铅矿为原料制备铅蓄电池的电极材料PbO2的工艺流程如图所示:

(1)方铅矿焙烧后排出气体的主要成分是______(填化学式),可用于工业制备________。
(2)步骤②中焦炭的作用是________。
(3)“粗铅”的杂质主要有锌、铁、铜、银等。电解精炼时,________作阴极,阴极反应式为________,阳极泥的主要成分是________。
(4)步骤⑤中制备PbO2的离子方程式________。
(5)已知:常温下,Ksp(PbS)=8×10-28、Ka1(H2S)=1.3×10-7、Ka2(H2S)=7.1×10-15。常温下,向Pb(NO3)2溶液中通入H2S气体,发生反应的离子方程式是________;结合数据分析,该反应能否进行得基本完全?________(写出计算推理过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com