
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中![]() _________(填“增大”“不变”或“减小”);写出该混合溶液中所有离子浓度之间存在的一个等式:__________________________________________。
_________(填“增大”“不变”或“减小”);写出该混合溶液中所有离子浓度之间存在的一个等式:__________________________________________。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:________________。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为______________________。
(3)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入40 mL 0.1 mol·L-1 HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:
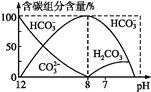
①在同一溶液中,H2CO3、HCO3-、CO32-____(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为____________,溶液中各种离子的物质的量浓度的大小关系为____________。
③已知在25 ℃时,CO32-水解反应的平衡常数即水解常数Kh=![]() =2.0×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____。
=2.0×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____。
【答案】 不变 c(CH3COO-)+c(OH-)=c(H+)+c(Na+) CO32-+H2O![]() HCO3-+OH- Na2CO3+CaSO4·2H2O
HCO3-+OH- Na2CO3+CaSO4·2H2O![]() CaCO3+Na2SO4+2H2O 不能 HCO3-、H2CO3 c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-) 10
CaCO3+Na2SO4+2H2O 不能 HCO3-、H2CO3 c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-) 10
【解析】本题主要考查盐类水解。
(1)K仅是温度的函数,温度不变,所以K=![]() 不变,电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+)。
不变,电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+)。
(2)土壤呈碱性的原因: ![]() +H2O
+H2O![]()
![]() +OH-。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为Na2CO3+CaSO4·2H2O
+OH-。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为Na2CO3+CaSO4·2H2O![]() CaCO3+Na2SO4+2H2O。
CaCO3+Na2SO4+2H2O。
(3)①![]() +H2O+CO2
+H2O+CO2![]() 2
2![]() ,所以在同一溶液中H2CO3、HC
,所以在同一溶液中H2CO3、HC![]() 、C
、C![]() 不能大量共存。
不能大量共存。
②![]() 水解使溶液呈碱性,当pH=7时,溶液中含碳元素的主要微粒为
水解使溶液呈碱性,当pH=7时,溶液中含碳元素的主要微粒为![]() 、H2CO3,溶液中各种离子的物质的量浓度的大小关系为c(Na+)>c(Cl-)>c(
、H2CO3,溶液中各种离子的物质的量浓度的大小关系为c(Na+)>c(Cl-)>c(![]() )>c(H+)=c(OH-)。
)>c(H+)=c(OH-)。
③Kh=![]() =2.0×10-4,当溶液中c(HC
=2.0×10-4,当溶液中c(HC![]()
![]() )=2∶1时,c(OH-)=1×10-4mol/L,c(H+)=
)=2∶1时,c(OH-)=1×10-4mol/L,c(H+)= 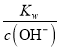 =
=![]() -mol/L =1×10-10mol/L, pH=10。
-mol/L =1×10-10mol/L, pH=10。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。![]() 固定装置已略去
固定装置已略去![]()
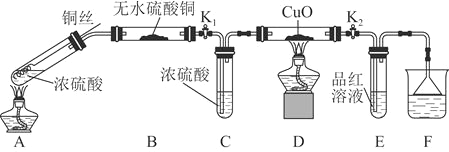
(1)A中反应的化学方程式为____________。
(2)F烧杯中的溶液通常是________________。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是______。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是______。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为_______。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
硫酸(mol/L) | 黑色物质出现的温度(℃) | 黑色物质消失的温度(℃) |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是_________。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用bmol/LNa2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为________。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);
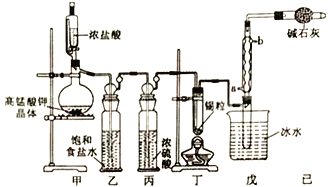
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)戊装置中冷凝管的进水口为___________(填“a”或“b”)。
(2)用甲装置制氯气,MnO4-被还原为Mn2+,该反应的离子方程式为________________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:①促进氯气与锡反应;②_______________________________。
(4)如果缺少乙装置,可能产生的后果是___________________;己装置的作用是__________________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 C.溴水 d.AgNO3溶液
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38 gSnCl4,则SnCl4的产率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1.0 L的恒容密闭容器中,反应2H2(g)+CO(g) ![]() CH3OH(g)达到平衡。下列说法不正确的是
CH3OH(g)达到平衡。下列说法不正确的是
容器 | 温度/K | 起始浓度/(mol/L) | 平衡浓度/(mol/L) | ||
H2 | CO | CH3OH | CH3OH | ||
① | 400 | 0.20 | 0.10 | 0 | 0.08 |
② | 400 | 0.40 | 0.20 | 0 | X |
③ | 500 | 0 | 0 | 0.10 | 0.025 |
A. X = 0.16 B. 该反应的正反应是放热反应
C. 平衡时的反应速率:②>① D. 400 K 时该反应平衡常数的值为2500
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸和醋酸盐在日常生活和生产中的应用很广泛。
(1)25℃时,pH=11的CH3COONa溶液中由水电离产生的c(OH-) =___________,其溶液中离子浓度按由大到小的顺序为__________________。pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________(填“酸性”、“中性”或“碱性”),溶液中c(Na+)________c(CH3COO-)(填“>”、“=”或“<”)。
(2)25℃时,向0.lmol![]() 的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是______________________________________________。
的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是______________________________________________。
(3)室温下,如果将0.lmol CH3COONa固体和0.05mol HCl全部溶于水形成混合溶液2 L。在混合溶液中:
①________和________两种粒子的物质的量之和等于0.1mol。
②c(CH3COO-)+ c(OH-)—c(H+)= _______mol/L。
(4)25℃时,将amol 醋酸钠溶于水,向该溶液滴加 b L稀醋酸后溶液呈中性,则所滴加稀醋酸的浓度为_______mol·L-1。(25℃时CH3COOH的电离平衡常数Ka = 2×10-5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种重要的医药中间体,其制备流程如下图所示。
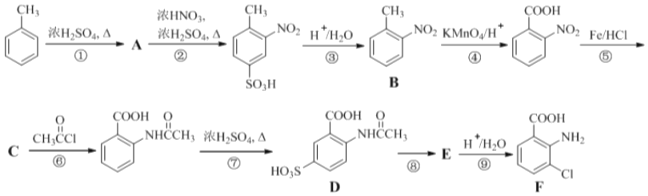
已知: 。
。
回答下列问题:
(1)![]() 的名称为___________,其分子中共面原子数目最少为______________。
的名称为___________,其分子中共面原子数目最少为______________。
(2)![]() 直接硝化也可以制得B,但上述流程却经由①②③三步反应制取B,其目的是__________________。
直接硝化也可以制得B,但上述流程却经由①②③三步反应制取B,其目的是__________________。
(3)反应⑥的主要目的是______________。上述流程中不属于取代反应的有______(填序号)。
(4)有机物C 中含氧官能团的名称为__________;写出反应⑧的化学方程式:____________________。
(5)符合下列条件的B 的同分异构体共有______种。
a.苯环上有两个取代基 b.既能发生银镜反应又能发生水解反应
(6)已知当苯环上有硝基时,再引入的其他基团主要进入它的间位。以苯为主要原料,其他无机原料自选,设计一个合成![]() 的合成路线:_______________________。示例:A
的合成路线:_______________________。示例:A![]() B……→目标产物。
B……→目标产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种物质的相对能量如下表所示:
物质 | NO2(g) | NO(g) | SO2(g) | SO3(g) |
相对能量/kJ | 429 | 486 | 99 | 0 |
工业上,常利用下列反应处理废气:NO2(g)+SO2(g)=NO(g)+SO3(g) △H等于
A. +42kJ·mol-1 B. -42kJ·mol-1 C. -84kJ·mol-1 D. +84kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A的结构简式如下:
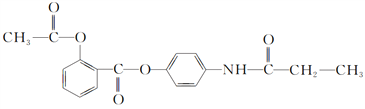
(1)A的分子式是________。
(2)A在NaOH溶液中充分加热后,再加入过量的盐酸酸化后,可得到B、C、D和![]() 四种有机物,且相对分子质量大小关系为B>C>D,则B、C、D的结构简式分别是B________;C________;D________。
四种有机物,且相对分子质量大小关系为B>C>D,则B、C、D的结构简式分别是B________;C________;D________。
(3)在B的同分异构体中,属于1,3,5三取代苯的化合物的结构简式__________________。
(4)写出B与碳酸氢钠反应的化学方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池构造如图所示,下列叙述正确的是( )
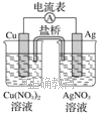
A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 原电池的总反应式为Cu+2AgNO3===2Ag+Cu(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com