
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(s) ΔH>0,若0~15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
H2(g)+I2(s) ΔH>0,若0~15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
A.0~15s内用I2的平均反应速率为v(I2)=0.001mol·L-1·s-1
B.c(HI)由0.07mol·L-1降到0.05mol·L-1所需的反应时间为小于10s
C.升高温度正反应速率加快,逆反应速率减慢
D.减小反应体系的体积,化学反应速率加快
【答案】D
【解析】
A. 015s内c(HI)由0.1molL1降到0.07molL1,v(HI)=0.03molL-1/15s=0.002mol·L-1·s-1,由速率之比等于化学计量数之比可知,v(I2)=0.002mol/(Ls)×1/2=0.001mol·L-1·s-1,但I2(s)为固体,不能表示反应速率,A错误;
B.若速率不变,c(HI)由0.07 molL1降到0.05 molL1,所需的反应时间为0.02mol·L-1/0.002mol·L-1·s-1=10s,但随反应进行浓度减小,反应速率减小,则c(HI)由0.07 molL1降到0.05 molL1所需的反应时间大于10s,B错误;
C.升高温度,正逆反应速率均增大,且正反应速率大于逆反应速率,平衡正向移动,C错误;
D. 减小反应体系的体积,压强增大,则化学反应速率加快,D正确;故答案为:D。


科目:高中化学 来源: 题型:
【题目】溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通 常是用溴化钠与一定浓度的硫酸和乙醇反应。某课外小组欲在 实验室制备溴乙烷的装置如图,实验操作步骤如下:
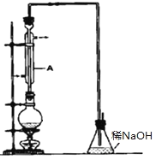
①检查装置的气密性;②在圆底烧瓶中加入 95%乙醇、80% 硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;③小心加热, 使其充分反应。请回答下列问题。
(1)装置 A 的作用是_____。
(2)反应时若温度过高,则有 SO2 生成,同时观察到还有一种红棕色气体产生,该气体的分子式是_____。
(3)反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中 的_________(填写上正确选项的字母)。
a 亚硫酸钠溶液 b 乙醇 c 四氯化碳
该实验操作中所需的主要玻璃仪器是______。(填仪器名称)。
(4)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水 CaCl2,然后进行的实验操作是__________。(填写正确选项的字母)。
a 分液 b 蒸馏 c 萃取
(5)为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验,其原因 是_________。通常采用的方法是取少量溴乙烷,然后_____(按 实验的操作顺序选填下列序号)。
①加热 ②加入 AgNO3 溶液 ③加入稀 HNO3 酸化 ④加入 NaOH 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
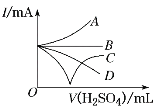
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:__。
(2)下列三种情况下,离子方程式与(1)相同的是__(填字母)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至![]() 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图中的__曲线表示(填字母)。
(4)化合物高铁酸钾K2FeO4可作为一种“绿色高效多功能”的水处理剂,可由FeCl3和KClO在强碱条件下反应制得,该反应的离子方程式为__(反应物写Fe3+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
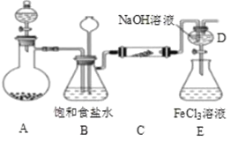
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为__;装置B中饱和食盐水的作用是___;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__。
(2)甲同学为验证氯气是否具有漂白性,在装置C中放入干燥的有色布条,实验中观察到有色布条褪色,能否说明氯气具有漂白性___,说明理由__。
(3)利用D、E装置可制取高效的水处理剂高铁酸钠(Na2FeO4),请写出E中的化学反方程式___。
(4)上述制备氯气并进行相关实验的装置存在明显的缺陷,请指出___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.明矾溶于水产生Al(OH)3胶体,离子方程式可表示为:Al3++3H2O=Al(OH)3↓+3H+
B.![]() 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物![]() ,该反应符合绿色化学的原则
,该反应符合绿色化学的原则
C.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
D.聚氯乙烯塑料制品可用于食品的包装
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定容积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。则N2、H2、NH3的起始浓度不可能存在的数据是( )
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。则N2、H2、NH3的起始浓度不可能存在的数据是( )
A.N2为0.2mol/L,H2为0.6mol/L
B.N2为0.15mol/L
C.N2、H2均为0.18mol/L
D.NH3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,X均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示![]() 部分产物已略去
部分产物已略去![]() 。则A、X不可能是
。则A、X不可能是
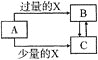
选项 | A | X |
A |
| C |
B |
|
|
C |
| NaOH |
D |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1—溴丁烷的反应如下:
NaBr+H2SO4HBr+NaHSO4 ①
R—OH+HBr![]() R—Br+H2O ②
R—Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备实验中,下列仪器最不可能用到的是________。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.长颈漏斗
(2)溴代烃的水溶性______(填“大于”、“等于”或“小于”)相应的醇,将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在______(填“上层”、“下层”或“不分层”)
(3)制备操作中,加入的浓硫酸必需进行稀释,其目的是____________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是____________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于______________ ;
但在制备1—溴丁烷时却不能边反应边蒸出产物,其原因是_______________________。
(6)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2后进行的实验操作是______(填字母)
a.分液 b.蒸馏 c.萃取 d.过滤
(7)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后______(按实验的操作顺序选填下列序号)①加热 ②加入AgNO3 ③加入稀HNO3 ④加入NaOH溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是

A. 5min时该反应的K值一定小于12 min时的K值
B. 0~5min内,v (H2)=0.05mol/(Lmin)
C. 10 min时,改变的外界条件可能是减小压强
D. 该反应混合气体的平均相对分子质量:5min时小于12 min 时的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com