
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.工业制硫酸的反应中,若通入128 g SO2,生成SO3的分子数目为2NA
B.2 mol Na2S分子中含有S原子的数目为2NA
C.标准状况下,6.72 L NH3溶于水后,溶液中NH3·H2O和![]() 数目之和为0.3NA
数目之和为0.3NA
D.Zn与浓硫酸充分反应后,收集到气体0.5 mol,电子转移的数目为NA
【答案】D
【解析】
根据反应可逆原理判断物质的量,锌与硫酸反应先生成二氧化硫,后生成氢气,根据电荷转移守恒进行计算。
A. 工业制硫酸的反应中,通入128 g 即2molSO2,2SO2+2O22SO3反应可逆,生成SO3的物质的量小于2mol,分子数目小于2NA,A错误;
B. Na2S是离子化合物,不存在Na2S分子,B错误;
C. 标准状况下,6.72 L 即0.3molNH3溶于水后,溶液中存在NH3、NH3·H2O、NH4+三种粒子,溶液中NH3·H2O和![]() 数目之和小于0.3NA,C错误;
数目之和小于0.3NA,C错误;
D. Zn与浓硫酸反应生成二氧化硫,根据电子转移守恒,Zn~SO2,若反应一段时候后硫酸浓度下降,开始生成氢气,根据电子转移守恒,Zn~H2,即无论反应到哪步,生成0.5mol气体,都消耗0.5mol锌,反应转移1NA电子,D正确。
答案为D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(气)+3B(气)![]() 2C(气)+2D(固)达到平衡的标志的是
2C(气)+2D(固)达到平衡的标志的是
①C的生成速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化 ④恒容下,混合气体的密度不再变化
⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧ C.①③④⑦ D.②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物乙苯(![]() )的说法正确的是
)的说法正确的是
A.沸点比苯高
B.分子中所有碳原子不可能共平面
C.二氯代物共有12种
D.能与H2发生加成反应,说明分子中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年3月21日是第二十六届“世界水日”,保护水资源、合理利用废水、节省水资源、加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1 L,进行了三组实验,其操作和有关图像如下所示:
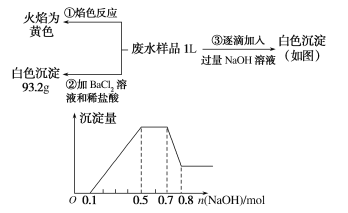
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是________
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子方程式:___________。沉淀溶解时发生的离子方程式为________
(3)分析图像,在原溶液中c(NH4+与c(Al3+)的比值为________,所得沉淀的最大质量是________g。
(4)若通过实验确定原废水中c(Na+) =0.18 mol·L-1,试判断原废水中NO3-是否存在?________(填“存在”“不存在”或“不确定”)。若存在,c(NO3-)=________ mol·L-1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球土壤中含有H、Ne、Na、Mg、Si、S、Cl、Cu等多种元素,是人类未来的资源宝库,回答下列问题:
(1)在下列电子构型中,属于Na原子的激发态构型的是______
A.1s22s22p63s1 B.1s2s22p63p1
C.1s22s22p63s13p1 D.1s22s22p43s3
(2)基态Na、Na+、O、Ne电离最外层一个电子所需能量从小到大的顺序为_________
(3)三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,其电离方程式为I2C16![]() ICl2++ICl4-。ICl2+离子的立体构型为______, 中心原子的杂化类型是_____。
ICl2++ICl4-。ICl2+离子的立体构型为______, 中心原子的杂化类型是_____。
(4)在[ Cu( NH3)4]2+中∠HNH比游离的氨气分子中∠HNH______,(填“大”“小”或“相等"),原因是_______
(5)已知MgO晶体结构与NaCl类似,Mg2+周围最近的O2-组成的多面体的形状为_____,MgO的熔点高于Na2O的原因是_________
(6)硅的晶体结构属于金刚石型,晶胞如图所示。已知其密度为ρgcm-3 ,设NA为阿伏加德罗常数的值,则晶胞参数a=_____nm,晶体中Si—Si 键的键长为_______ nm(用含 p、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L容器中发生反应,A、B、C物质的量随时间变化的曲线如图所示。下列叙述中正确的是
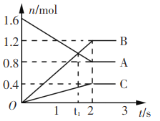
A.该反应的化学方程式为2A![]() B+3C
B+3C
B.反应开始至2s时,A的平均反应速率为0.4 mol(/L·s)
C.t1时刻,该反应达到化学平衡状态
D.反应开始至1s时,生成C的物质的量大于0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,并制备硫酸。设计装置如图所示(已知电极为石墨电极只起导电作用,交换膜分别是只允许阴阳离子通过的阴阳离子交换膜)。下列叙述中错误的是
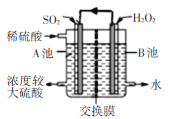
A.该交换膜为阳离子交换膜
B.若11.2 L(标准状况)SO2参与反应,则A池中增加2 mol H+
C.B池中的反应为H2O2+2e-+2H+=2H2O
D.导线上箭头方向表示电流方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程。
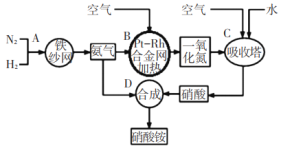
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:_____。
(2)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为![]() ,此时H2的转化率为_____。
,此时H2的转化率为_____。
(3)设备B中反应的化学方程式为____。
(4)利用以上流程,若N2与H2合成氨时,H2的转化率如上题所求,氨气催化氧化制硝酸时损失20%,其他环节损失忽略不计,则9吨H2最多可制取_____吨硝酸铵。
(5)某课外小组运用原电池原理合成氨,其装置结构如图所示:
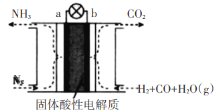
该装置的负极为_____(填a或b),试写出a极的电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼钼的化学原理为:
①2MoS2+7O2![]() 2MoO3+4SO2
2MoO3+4SO2
②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl
④H2MoO4![]() MoO3+H2O
MoO3+H2O
⑤用还原剂将MoO3还原成金属钼。则下列说法中正确的是
A.MoS2煅烧产生的尾气可以直接排到空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com