
| 选项 | 环境要求 | 离子 |
| A | 溶液中c(K+)<c(Cl-) | K+、AlO2-、Cl-、NO3- |
| B | NaHCO3溶液 | K+、ClO-、AlO2- |
| C | 水电离产生的c(H+)=10-12 mol/L-1的溶液 | ClO-、CO32-、NH4+、NO3-、SO32- |
| D | 逐滴滴加氨水立即有沉淀产生 | Na+、HCO3-、Mg2+、SO42- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶液中c(K+)<c(Cl-),由电荷守恒可知c(H+)>c(OH-),溶液应呈酸性;
B.与HCO3-反应的离子不能大量共存;
C.水电离产生的c(H+)=10-12 mol/L-1的溶液可能呈酸性或碱性;
D.逐滴滴加氨水立即有沉淀产生,应生成氢氧化镁,离子之间不发生反应.
解答 解:A.溶液中c(K+)<c(Cl-),由电荷守恒可知c(H+)>c(OH-),溶液应呈酸性,酸性条件下AlO2-不能大量共存,故A错误;
B.AlO2-与HCO3-发生互促水解反应而不能大量共存,故B错误;
C.水电离产生的c(H+)=10-12 mol/L-1的溶液可能呈酸性或碱性,碱性条件下NH4+不能大量共存,酸性条件下ClO-、NO3-与SO32-发生氧化还原反应而不能大量共存,故C错误;
D.逐滴滴加氨水立即有沉淀产生,应生成碳酸镁,离子之间不发生反应,可大量共存,故D正确.
故选D.
点评 本题考查离子共存,为高考常见题型,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握离子的性质以及反应类型的判断,把握题给信息,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c>d | B. | 离子半径:C(n+1)->Dn->A(n+1)+>Bn+ | ||
| C. | 单质还原性:B>A,氧化性:D>C | D. | 原子半径:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
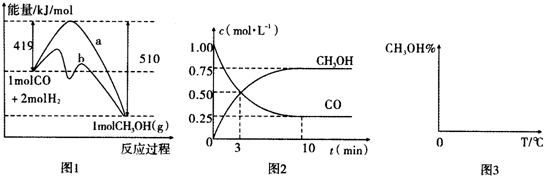
 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.| 浓度(mol/L) 物质 时间/min | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
| H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于C2H4(g)+H2O(g)═C2H5OH(g)在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为l mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)═2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol.若此时A、B和C均增加1 mol,平衡正向移动 | |
| C. | 一恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)═2NH3(g)达到平衡状态时,N2、H2、NH3各l mol,若此时再充入3mol N2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
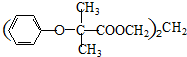
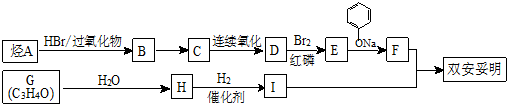
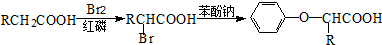
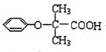 .
.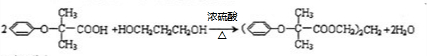 .
. .
.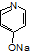 (
(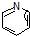 与
与 苯环性质相似)与
苯环性质相似)与 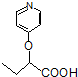 合成的路线:
合成的路线: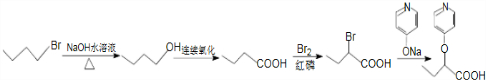 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:X<Y | |
| B. | 原子半径:Y>Z | |
| C. | 最简单氢化物的热稳定性:Z>W | |
| D. | Y元素氧化物不溶于X元素最高价氧化物对应水化物的水溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com