
50 ml 1.0 mol·L-1盐酸与50 mL 1.1 mol·L-1 NaOH溶液在如下图1所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.回答下列问题:

①从实验装置上看,大烧杯上没有________,会导致求得的中和热数值________(填“偏大”“偏小”或“无影响”);实验装置中也缺少环形玻璃搅拌棒,若用环形铜质搅拌棒代替,会导致求得的中和热数值________(填“偏大”“偏小”或“无影响”).
②若实验中分多次把NaOH溶液倒入盛有盐酸的小烧杯中,则求得的中和热数值________(填“偏大”“偏小”或“无影响”)
③若实验中改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),该实验中NaOH溶液的浓度大于盐酸浓度的作用是________.
④若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”).
⑤当室温低于10℃时进行实验,对实验结果会造成较大误差,其原因是________.
⑥若将V2mL未知浓度的NaOH溶液,加入内盛有V1mL 1.0 mol/L HCl溶液的小烧杯中混合均匀后测量并记录溶液温度,且每次实验中均保持V1+V2=100 mL,实验结果如下图2所示(以温度为纵坐标,V1为横坐标).做该实验时环境温度________22℃(填<、=、>),NaOH溶液的浓度约为________mol/L
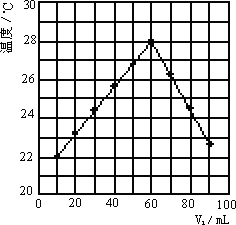
科目:高中化学 来源:安徽省安工大附中、红星中学2011-2012学年高二3月联考化学试题 题型:058
50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
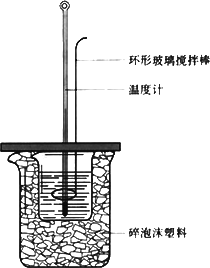
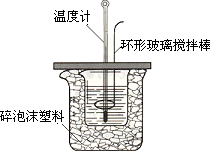
(1)大小烧杯间填或“不能”)将环形玻璃搅拌棒改为环形金属(如铜).其原因是________.
(2)大烧杯上如不满碎泡沫塑料的作用________.
(3)________(填“能”盖硬纸板,对求得中和热数值的影响是________(填“偏高”或“偏低”或“无影响”).
(4)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量________(“增加”、“减少”或“不变”),所求中和热数值________(“增加”、“减少”或“不变”).
查看答案和解析>>
科目:高中化学 来源:河南省许昌部分学校2011-2012学年高二上学期期末联考化学试题 题型:058
50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
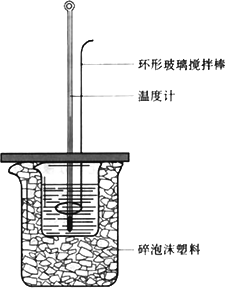
(1)大小烧杯间填或“不能”)将环形玻璃搅拌棒改为环形金属(如铜).其原因是________.
(3)大烧杯上如不满碎泡沫塑料的作用________.
(2)________(填“能”盖硬纸板,对求得中和热数值的影响是________(填“偏高”或“偏低”或“无影响”).
(4)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量________(“增加”、“减少”或“不变”),所求中和热数值________(“增加”、“减少”或“不变”).
查看答案和解析>>
科目:高中化学 来源:河北省张家口市涿鹿中学2010-2011学年高二上学期第一次月考文科化学试题 题型:058
50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
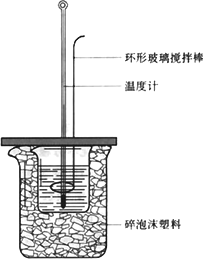
(1)大小烧杯间填满碎泡沫塑料的作用________.
(2)________(填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒.其原因是________.
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是________(填“偏高”或“偏低”或“无影响”).
(4)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量________(“增加”、“减少”或“不变”),理由是________;所求中和热数值________(“增加”、“减少”或“不变”),理由是________.
查看答案和解析>>
科目:高中化学 来源:志鸿系列必修一训练化学苏教版 苏教版 题型:021
|
下列溶液中,跟100 mL 0.5 mol·L-1 NaCl溶液中的Cl-物质的量浓度相同的是 | |
A. |
100 mL 0.5 mol·L-1 MgCl2溶液 |
B. |
200 mL 0.25 mol·L-1 CaCl2溶液 |
C. |
50 mL 1.0 mol·L-1 NaCl溶液 |
D. |
25 mL 0.5 mol·L-1 HCl溶液 |
查看答案和解析>>
科目:高中化学 来源:新课标2010-2011学年高二上学期单元测试(1)化学试题(新人教) 题型:058
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L氢氧化钠溶液在下图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值________(填偏高、偏低或不变);
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据.
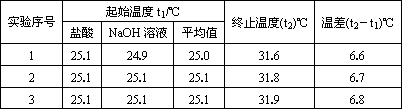
已知盐酸、NaOH溶液密度近似为1.00 g/cm3中和后混和液的比热容C=4.18 J(g.·℃)则该反应的中和热为ΔH=________;
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会________(填偏高、偏低或不变),其原因是________;
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,试分析此操作步骤对实验测定中和热的影响________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com