
| A. | 电解池的反应属于自发过程 | |
| B. | 化学反应热效应数值与参加反应的物质多少有关 | |
| C. | 化学反应过程中的能量变化除了热能外,也可以是光能、电能等 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
分析 A、电解池的反应是属于非自发进行的氧化还原反应;
B、参加反应的物质越多,放出热量越多;
C、根据化学反应过程中的能量变化形式分析;
D、热化学方程式中的化学计量数只表示物质的量,可以是分数.
解答 解:A、电解池的反应是属于非自发进行的氧化还原反应,故A错误;
B、参加反应的物质越多,放出热量越多,所以化学反应热效应数值与参加反应的物质多少有关,故B正确;
C、根据化学反应过程中的能量转化形式分析,除了热能外,也可以是光能、电能等,故C正确;
D、热化学方程式中的化学计量数只表示物质的量,可以是分数,故D正确.
故选:A.
点评 本题主要考查了放热与吸热反应的原因、常见的吸热和放热反应、反应自发进行的判断依据应用,原电池、电解池原理是理解解题关键,是对基本知识的考查,较简单.


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| B. | 煤经气化和液化等物理变化可转化为清洁燃料 | |
| C. | 以淀粉为原料可制取乙酸乙酯 | |
| D. | 苯和油脂均不能使酸性髙锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑥ | C. | ②④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现象 | 结论 |
| A | 实验1:4mL 0.01mol/L KMnO4酸性溶液+2mL 0.1mol/LH2C2O4溶液+4mL水; 实验2:4mL 0.01mol/L KMnO4酸性溶液+4mL 0.1mol/L H2C2O4溶液+2mL水; 记录褪色时间. | 实验2先褪色 | H2C2O4浓度越大反应速率越快. |
| B | 用洁净铂丝蘸取无色溶液进行焰色反应 | 火焰呈黄色 | 无色溶液为钠盐溶液 |
| C | 向砖红色Ag2CrO4沉淀上滴加 0.1mol/LNaCl溶液 | 沉淀变为黑色 | Ksp(Ag2CrO4)>Ksp(AgCl) |
| D | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸未发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁制品镀层受损后,铁制品也不容易生锈 | |
| B. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH | |
| C. | 粗铜精炼时,电镀液中的c(Cu2+)保持不变 | |
| D. | 将钢闸门与直流电源的负极相连,可降低钢闸门腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
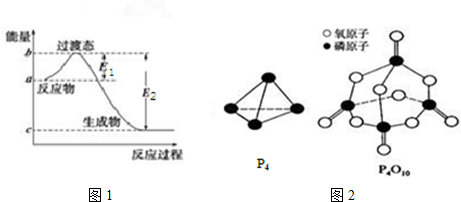
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
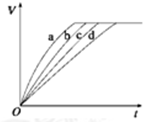 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )| 组别 | 对应曲线 | C(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度可能最大 | |
| C. | 第2组实验中盐酸的浓度可能等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度可能低于30℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com