
| A. | 0.24mol | B. | 0.21mol | C. | 0.25mol | D. | 0.12mol |
分析 混合物与硝酸反应时恰好使混合物完全溶解,且所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为硝酸亚铁.由铁元素守恒可知,足量的CO在加热下还原相同质量的混合物,能得到铁的物质的量与硝酸亚铁中的铁的物质的量相同,根据硝酸的物质的量和生成NO的物质的量,求出溶液中硝酸亚铁的物质的量.
解答 解:因一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,无血红色出现,说明溶液中的溶质为硝酸亚铁,
根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量为0.12L×4mol/L-$\frac{1.344L}{22.4L/mol}$=0.42mol,所以硝酸亚铁的物质的量为$\frac{0.42mol}{2}$=0.21mol,由铁元素守恒可知,得到铁的物质的量为n(Fe)=0.21mol.
故选B.
点评 本题考查学生利用原子守恒的方法来计算,明确硝酸亚铁与硝酸的关系,硝酸亚铁中铁元素与原混合物中的铁元素的关系是解答的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
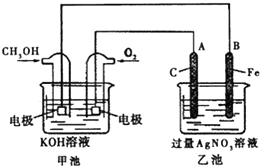 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
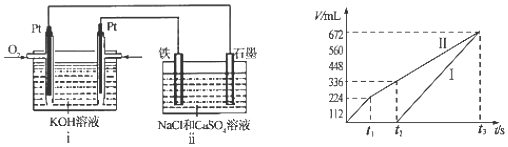
 某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:| 序号 | 烧瓶中的物质 | 测得气体体积 |
| 实验1 | 20mL H2O2,足量MnO2 | V1 |
| 实验2 | 20mL H2O2,足量MnO2和稀硫酸 | V1<V2<2V1 |
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| Ⅰ | 1.0g | 10.00mL | 346.30mL |
| Ⅱ | 1.0g | 10.00mL | 335.50mL |
| Ⅲ | 1.0 g | 10.00mL | 346.00mL |
| Ⅳ | 1.0g | 10.00mL | 345.70mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化合物 | 甲 | 乙 | 丙 |
| 组成元素 | B、C | A、C | C、D |
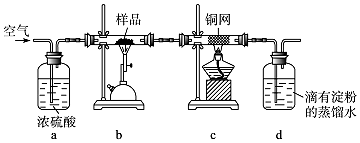
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
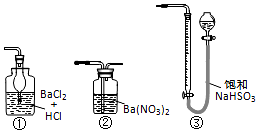
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
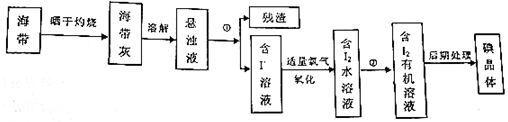
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com