
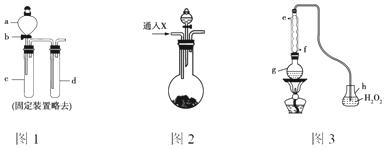
���� ��1����ͼ1Ϊ��Һ��������ȡ����ķ�Ӧ������Na2SO3 ������Ũ���ᷴӦ�Ʊ������������壻�ڸ��ݶ�����������ļ��鷽�������жϣ���β���ɷ���Ҫ�Ƕ�������Ϊ������Ⱦ���ѡ���Լ����գ�
��2���������ƺ����ᷴӦ���ɶ����������������Ȼ�����Һ����Ӧ��d���а�ɫ�������ɣ�������Һ�к���������������������������������뱵���ӷ�Ӧ�������ᱵ������
��3���ٶ���������л�ԭ�ԣ��ܹ���������ⷴӦ�������ᣬ�ݴ�д����Ӧ�Ļ�ѧ����ʽ��
�ڸ��ݹ�ϵʽ2NaOH��H2SO4��SO2���������Ƶ����ʵ������������������������ټ���������Ѿ��еĶ�����������
��� �⣺��1����A�������ӷ���Na2SO3��Һ��HNO3��Ӧ�����ɵ������к������ᣬ��A����
B��ǿ����Ʊ����ᣬNa2SO3������Ũ���ᷴӦ���������ƺͶ��������ˮ����ӦNa2SO3+H2SO4=Na2SO4+H20+SO2������Ӧ������ȣ�����װ���ص㣬��B��ȷ��
C���������ڴ�����ȼ�գ����ɶ����������ܺ����������ʣ��Ҳ�����ͼ1װ���ص㣬��C����
D����ͼ��ʾװ��û�м��ȣ�������Ũ�����ͭ��Ӧ�Ʊ�����D����
�ʴ�Ϊ��B��
����Ҫ֤��c�����ɵ�������SO2�����ݶ���������ʹƷ����Һ��ɫ�����Ȼָ���ɫ��d�м���Ʒ����Һ����b����Ӧ��ʼ����d����Һ��ɫ��ȥ���ټ����Թ�d�е���Һ����ɫ�ָֻ���֤��������SO2��
�ʴ�Ϊ����ɫ�����ȣ�
��β���ɷ���Ҫ�Ƕ�������Ϊ������Ⱦ�������һβ������װ�÷�ֹ��Ⱦ�������ŷŵ������У�d�е�����ͨ��NaOH��Һ�У�����β���е�SO2��
�ʴ�Ϊ��d�е�����ͨ��NaOH��Һ�У�����β���е�SO2��
��2���������ƺ����ᷴӦ���ɶ����������������Ȼ�����Һ����Ӧ��d���а�ɫ�������ɣ��Ƕ��������������������ܷ����ķ�ӦΪ��2SO2+2H2O+O2+2BaCl2=2BaSO4��+4HCl��2SO2+2H2O+O2=2H2SO4��H2SO4+BaCl2=BaSO4��+2HCl��
�ʴ�Ϊ��BaSO4�� SO2����Һ�б�O2������H2SO4��
��3����˫��ˮ���������ԣ��ܹ��������������������ᣬ��Ӧ�Ļ�ѧ����ʽΪ��SO2+H2O2=H2SO4��
�ʴ�Ϊ��SO2+H2O2=H2SO4��
�ڸ���2NaOH��H2SO4��SO2��֪SO2������Ϊ��$\frac{1}{2}$����0.0900mol/L��0.025L����64g/mol=0.072g�������Ѿ��еĶ���������Ϊ��$\frac{0.72g}{0.3L}$=0.24g/L��
�ʴ�Ϊ��0.24��
���� ���⿼�������仯�������ʵ�Ӧ�ã�����ʵ���Ʊ�������װ��ע�����⣬��Ҫ�����������Ļ�ԭ�ԡ��������ʺ����ķ�������ȷ���������ǽ��ؼ�����������������ѧ���Ļ�ѧʵ����������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��ͼʵ�飺��������ƽ����һ���������Ȼ��ƹ��� | |
| B�� |  ��ͼʵ�飺����һ�����ʵ���Ũ�ȵ����� | |
| C�� |  ��ͼʵ�飺�ñ���ȡ��ˮ�е������з�Һ | |
| D�� | 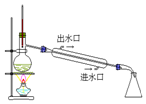 ��ͼʵ�飺�������������Ȼ�̼���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe��FeSO4 | B�� | Cu��NO3��2��Cu | C�� | CO��CO2 | D�� | NaCl��AgCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ | B�� | ����ά����C | C�� | ������ţ�� | D�� | ��ʳ�ô� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
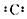 B-�Ľṹʾ��ͼ
B-�Ľṹʾ��ͼ C+�ĵ���ʽNa+
C+�ĵ���ʽNa+�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������۱���ɫ�������⡱ָ��Ԫ�� | |
| B�� | Ϊ�˲��⣬Ҫ��ʳ�ú��ߵ����ʳ�� | |
| C�� | ��ˮ�м���CCl4��ֻ�Ϻ��÷ֲ㣮CCl4���²㣬�����Ϻ�ɫ�������̫��ʵ�����л��������Һ�壬CCl4��δ�����²� | |
| D�� | ͨ����ȡ�������ա��ܽ�����ˡ���ȡ���ɴӺ�������ȡ���ʵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com