
 对于可逆反应:mA(g)+nB(g)?xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )
对于可逆反应:mA(g)+nB(g)?xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )| A. | △H>0,m+n>x | B. | △H>0,m+n<x | C. | △H<0,m+n<x | D. | △H<0,m+n>x |
分析 根据图(1)到达平衡时所用时间的长短判断压强p1和p2的相对大小,增大压强,化学平衡向气体体积减小的方向移动,由此判断反应前后气体化学计量数的相对大小;根据图(2)判断,升高温度,化学平衡向吸热方向移动,再结合A的转化率判断该反应的正反应是放热还是吸热.
解答 解:由图(1)知,p2到达平衡时所用时间长,p1到达平衡时所用时间短,所用压强为p2的反应速率慢,为p1的反应速率快,压强越大反应速率越大,所以p2<p1;增大压强,化学平衡向气体体积减小的方向移动,由图象知,A的转化率增大,平衡向正反应方向移动,所以反应前的计量数大于反应后的计量数,即m+n>x;
图(2)知,随着温度的升高,A的转化率减低,平衡向逆反应方向移动,升高温度,平衡向吸热反应方向移动,所以逆反应方向是吸热反应,正反应是放热反应,即△H<0.
故选D.
点评 本题考查化学平衡图象题,题目难度中等,注意温度、压强对反应速率和化学平衡的影响.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
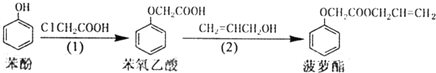
| A. | 步骤(1)、(2)的反应类型不同 | |
| B. | 步骤(1)产物中残留的苯酚能用FeCl3溶液检验 | |
| C. | 苯氧乙酸和菠萝酯均可与氢氧化钠溶液反应 | |
| D. | 步骤(2)产物中残留的烯丙醇不能用溴水检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若改变影响化学平衡的条件之一,平衡向能够使这种改变减弱的方向移动 | |
| B. | 达到化学平衡时,各组分的浓度不再改变,反应停止 | |
| C. | 化学平衡移动,化学平衡常数不一定改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它们的原子序数B>A>C | B. | 它们的离子半径A2->C->B2+ | ||
| C. | 它们的原子半径C>B>A | D. | 它们的最外层电子数C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
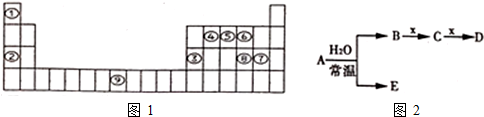
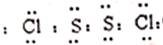 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 回答下列问题.
回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
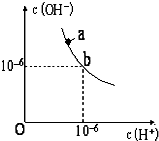
| A. | pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):③>②>① | |
| B. | 0.2mol•L-1 CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 四种短周期元素中W的原子半径最小 | |
| B. | Z元素在周期表中的位置是第三周期第ⅣA族 | |
| C. | 原子最外层电子数由多到少的顺序:Y>X>W>Z,最高正价由高到低顺序:W>Z | |
| D. | 元素非金属性由强到弱的顺序:W>Z,W的单质常温下可与氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com