
| A、标准状况下,22.4LN2含有分子数为NA |
| B、物质的量浓度为22.4 mol/L MgCl2溶液,含有Cl-数为NA |
| C、标准状况下,22.4 LH2O的分子数为NA |
| D、64g SO2含有氧原子数为NA |
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br->Fe2+>I- |
| B、I->Fe2+>Br- |
| C、Br->I->Fe2+ |
| D、Fe2+>I->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
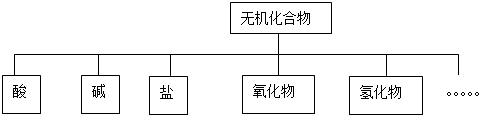
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验操作 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温. |
| Ⅱ | 取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解. |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红. |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com