
| A. |  图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+△Q,0<△Q;使用和未使用催化剂时,反应过程中的能量变化 | |
| B. |  图②表示25℃时,用0.01mol•L-1盐酸滴定一定体积的0.01mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. |  图③表示CH4(g)+H2O(g)?CO(g)+3H2(g)+△Q,反应CH4的转化率与温度、压强的关系,且p1>p2、0<△Q | |
| D. |  图④中曲线表示反应2SO2(g)+O2(g)?2SO3(g)+△Q,0<△Q;正、逆反应的平衡常数K随温度的变化 |
分析 A、因该反应是放热反应,应反应物的总能量大于生成物的总能量;
B、用0.01mol•L-1盐酸滴定一定体积的0.01mol•L-1 NaOH溶液,则起始氢氧根离子浓度为0.01mol•L-1,所以起始PH=12;
C、转化率与温度、压强图象有三个变量,采用“定一议二”方法判断压强大小;根据图象中压强不变,温度升高后甲烷的转化率判断该反应的焓变;
D、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系.
解答 解:A、图象a活化能减小,a使用了催化剂,因该反应是放热反应,应反应物的总能量大于生成物的总能量,但图象描述是吸热反应,故A错误;
B、用0.01mol•L-1盐酸滴定一定体积的0.01mol•L-1 NaOH溶液,则起始氢氧根离子浓度为0.01mol•L-1,所以起始PH=12,与图象不一致,故B错误;
C、通过图表可知当温度相同时,p2→p1时,甲烷的转化率提高,平衡向正向移动,正向为气体系数增大的反应,根据减小压强平衡向系数增大的方向移动可知:p1<p2;当压强为p1时,升高温度,甲烷的转化率提高,平衡向正向移动,说明正反应为吸热反应,△Q<0,故C错误;
D、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故D正确;
故选D.
点评 本题以图象与中和滴定、化学平衡、氧化还原反应、反应中的能量变化来考查学生,这些知识点是新课程改革考查的重点,明确考点“形变神不变”,做到善于抓规律、编网络来掌握即可.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
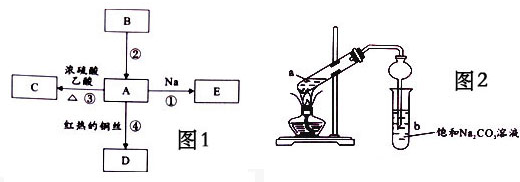
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2O2既是氧化剂又是还原剂 | |
| B. | K2FeO4的氧化性强于K2O2 | |
| C. | 16gFe2O3发生反应,有0.3mole-转移 | |
| D. | 用K2FeO4处理水时有Fe(OH)3胶体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 | |
| B. | 常温下,PH均为5的盐酸、氯化铵溶液中,水的电离程度相同 | |
| C. | 8NH3(g)+6NO(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 | |
| D. | 对于乙酸乙酯的水解反应(△H>0)加入少量氢氧化钠溶液并加热,该反应的反应速率和平衡常数均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | NaCl必须保存在棕色瓶中 | |
| D. | 含硫酸的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入NaOH溶液:c(Na+)=c(Cl-)+c(ClO-)+c(H+) | |
| B. | NaHCO3溶液:c(Na+)>c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合:c(CH3COO-)+c(CH3COOH)=0.1mol•L-1 | |
| D. | PH=11的氨水与PH=3的硫酸等体积混合:c(SO42-)=2c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1Mg(NO3)2溶液中含有0.2 NA个NO3- | |
| B. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| C. | 3mol Cu和足量稀硝酸反应产生2 NA个NO分子 | |
| D. | 1 mol Cl2与足量NaOH溶液反应,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com