
将a L NH3通入某恒压的密闭容器中,在一定条件下让其分解,达到平衡后气体体积增大到b L(气体体积在相同条件下测定)。下列说法中正确的是( )
A.平衡后氨气的分解率为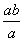 ×100%
×100%
B.平衡混合气体中H2的体积分数为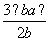 ×100%
×100%
C.反应前后气体的密度比为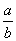
D.平衡后气体的平均摩尔质量为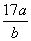 g
g
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
3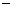 对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
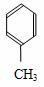 +CO
+CO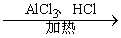 A
A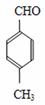
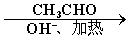 B
B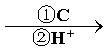
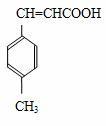
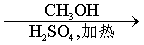 E
E
已知:HCHO+CH3CHO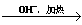 CH2=CHCHO+H2O。
CH2=CHCHO+H2O。
(1)遇FeCl3溶液显紫色的A的同分异构体有_______种。B中含氧官能团的名称为_____________。
(2)1molB最多能跟______mol H2发生加成反应。
H2发生加成反应。
(3)试剂C可选用下列中的_____________。
a、溴水 b、银氨溶液 c、酸性KMnO4溶液 d、新制Cu(OH)2悬浊液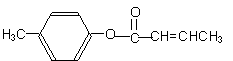
(4) 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________________________。
(5)E在一定条件下可以生成高聚物F,F的结构简式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室欲用氯化钠固体配制500mL、0.10mol·L-1的NaCl溶液,下列叙述正确的是( )
A.实验用到的仪器有:托盘天平、烧杯、1000mL容量瓶、玻璃棒
B.将称量好的固体放入500mL容量瓶中溶解
C.定容时若俯视刻度,则所得溶液浓度偏高
D.定容后翻转摇匀,发现液面下降,又加入蒸馏水到刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g)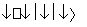 4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
A.增大反应体系的压强,反应速率可能加快
B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量
C.电解熔融的Al2O3和AlCl3溶液均能得到 单质铝
单质铝
D.将AlCl3·6H2O加热,也可制得无水氯化铝[来源:学科网]
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应原理在科研和生产中有广泛应用。
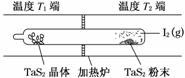
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”、“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为________________________________________________________________________。
(4)25℃时,H2SO3HSO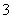 +H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中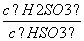 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)。
根据题意和所给图像完成下列各题:
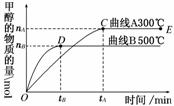
①反应达到平衡时,平衡常数表达式K=________。
②升高温度,K值________(填“增大”、“减小”或“不变”)。
(2)一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反应:3A(g)+B(g)xC(g)。若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol·L-1。
请填写下列空白:
①x=________。
②平衡混合物中,C的体积分数为50%,则B的转化率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
A.两条曲线间任意点均有c(H+)×c(OH-)=KW
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液里存在重要的酸碱平衡:CO2+H2OH2CO3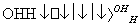 HCO
HCO ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO )∶c(H2CO3)变化关系如下表:
)∶c(H2CO3)变化关系如下表:
| c(HCO | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO 的水解程度大于电离程度
的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)>c(HCO )
)
D.pH=7.40的血液中,HCO 的水解程度一定大于H2CO3的电离程度
的水解程度一定大于H2CO3的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
物质A在水中发生电离,其电离方程式为A===X2++2Y-,则下列判断错误的是(双选)( )
A.A可以是盐类 B.A可以是酸类
C.A可以是碱类 D.A可以是酸、碱或盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com