
| A. | Y、Z、W原子半径依次增大 | |
| B. | X的最高价氧化物对应水化物的酸性比R的强 | |
| C. | X、R分别与Y形成的常见化合物中化学键类型相同 | |
| D. | 元素W、R的简单离子具有相同的电子层结构 |
分析 X、Y、Z、W、R是原了序数依次递增的短周期元素.X原子最外层电子数是其内层电子数的2倍,应为C元素,Y、R同主族,且两者核外电子数之和是X核外电子数的4倍,即为24,则Y为O元素,R为S元素,Z为短周期中金属性最强的元素,应为Na元素,W是地売中含量最高的金属元素,为Al元素,结合元素周期律的递变规律解答该题.
解答 解:由以上分析可知X为C、Y为O、Z为Na、W为Al、R为S元素,
A.Z为Na、W为Al,原子Na>Al,故A错误;
B.非金属性S>C,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,故B错误;
C.X、R分别与Y形成的常见化合物分别为二氧化碳、二氧化硫,都为共价化合物,化学键类型相同,故C正确;
D.W为Al、R为S元素,对应的离子的原子核外电子层数不同,故D错误.
故选C.
点评 本题考查了原子结构与元素周期律的综合应用,为高频考点和常见题型,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作与现象 | 结论 |
| A | 向蛋白质溶液中滴加Pb(NO3)2溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| B | 测定浓度为 0.1mol•L-1CH3COONa与HCOONa 溶液的pH,CH3COONa溶液的pH较大 | 酸性:CH3COOH>HCOOH |
| C | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量0.l mol•L-1AgNO3溶液,出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制铝:电解熔融态氯化铝 | B. | 制铁:以铁矿石为原料,CO还原得铁 | ||
| C. | 制镁:电解熔融态氯化镁 | D. | 制钠:电解熔融态氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
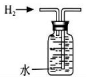 | 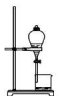 | 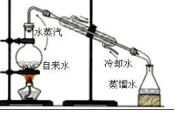 | 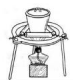 |
| A.排水法收集 H2 | B.分离油和水 | C.实验室制取少量蒸馏水中 | D.从饱和食盐水提取 NaCl晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
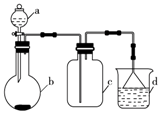 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 浓硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
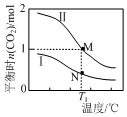 两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),起始物质的量见表.实验测得两容器不同温度下达到平衡时CO2的物质的量如图所示,下列说法正确的是( )
两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),起始物质的量见表.实验测得两容器不同温度下达到平衡时CO2的物质的量如图所示,下列说法正确的是( )| 容器 | 起始物质的量 | |
| NO | CO | |
| Ⅰ | 1 mol | 3 mol |
| Ⅱ | 6 mol | 2 mol |
| A. | N点的平衡常数为0.04 | |
| B. | M、N两点容器内的压强:P(M)>2P(N) | |
| C. | 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol•L-1 | |
| D. | 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04mol•L-1 | B. | 0.5mol•L-1 | C. | 0.54mol•L-1 | D. | 1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收废电池外壳的金属材料 | |
| B. | 防止废电池中的汞、镉和铅等重金属离子对土壤和水源的污染 | |
| C. | 不使电池中渗漏的电解液腐蚀其他物品 | |
| D. | 提炼稀有金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com