
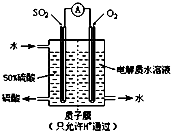
 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.| 1 |
| 2 |
| 1 |
| 2 |
| x2 |
| (a-x)(2a-x) |


科目:高中化学 来源: 题型:
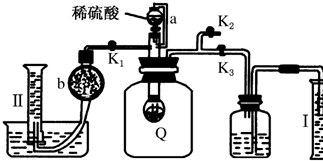 为测定保存在干燥环境中已部分变质的过氧化钠样品(只有一种杂质)的纯度,设计了如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开漏斗的活塞,将稀硫酸滴入气球中.
为测定保存在干燥环境中已部分变质的过氧化钠样品(只有一种杂质)的纯度,设计了如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开漏斗的活塞,将稀硫酸滴入气球中.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
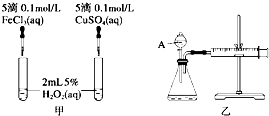 经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
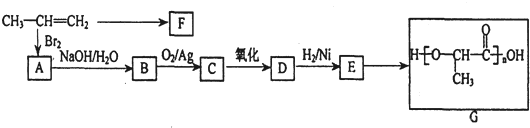
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 浓硫酸 |
| 170℃ |
| 加热 |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构简式为CH2CH2 |
| B、聚乙烯的单体为-CH2-CH2- |
| C、除去乙烷中的乙烯,常用酸性高锰酸钾溶液 |
| D、用水可以鉴别苯、乙醇、溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、NO3-、Cl-、Na+ |
| B、K+、SO32-、Cl-、NO3- |
| C、Na+、SO42-、Cl-、HCO3- |
| D、Na+、NO3-、K+、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com