
【题目】(Ι)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(2)某同学把新制的氯水加到NaNO2溶液中,请写出反应的离子方程式:________________。
(3)铝能溶解在碱性亚硝酸盐溶液中,生成能使湿润的红色石蕊变蓝的气体,请写出反应的离子方程式__________________;
(Ⅱ)某暗紫色化合物A在常温和干燥的条件下,可以稳定存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。经组成分析,该粉末仅含有O、K、Fe三种元素。另取3.96g化合物A的粉末溶于水,滴加足量稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。
下列物质中有可能提高化合物A水溶液稳定性的是 。
A.醋酸钠 B.醋酸 C.Fe(NO3)3 D.KOH
(2)请设计一个实验方案,研究温度对化合物A溶液稳定性的影响
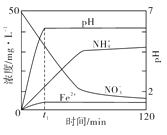
(3)下图表示足量 Fe粉还原KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式:
【答案】
(Ι)(1)B;
(2)Cl2+NO2-+H2O=NO3-+2Cl-+2H+;
(3)2Al+NO2-+OH-+H2O=NH3+AlO2-
(Ⅱ)(1)AD
(2)将适量K2FeO4固体溶解水并等分为两份,置于不同温度的恒温水浴中,底部各放一张画有“+”字的白纸,观察记录看不到“+”字所需时间
(3)4Fe+NO3-+10H+=4Fe2++NH4++3H2O
【解析】
试题分析:(Ι)(1)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A不选;B.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1-4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故B选;C.在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C不选;D.NaNO2和NaCl均能与AgNO3反应生成AgNO2和AgCl沉淀,但能AgNO2溶于硝酸,而AgCl不溶于硝酸,故可以鉴别开,故D不选;故答案为:B;
(2)新制的氯水能够氧化NaNO2溶液,反应的离子方程式为Cl2 + NO2- + H2O = NO3- + 2Cl-+2H+,故答案为:Cl2 + NO2- + H2O = NO3- + 2Cl-+2H+;
(3)铝能溶解在碱性亚硝酸盐溶液中,生成能使湿润的红色石蕊变蓝的气体氨气,反应的离子方程式为2Al+NO2-+OH-+H2O=NH3+AlO2-,故答案为:2Al+NO2-+OH-+H2O=NH3+AlO2-;
(Ⅱ)(1)A.高铁酸钾在水溶液中不稳定,醋酸钠溶液显碱性可以温度存在,故A正确;B.亚硫酸钠具有还原性,会被高铁酸钾氧化,故B错误;C.在常温和干燥的条件下,高铁酸钾可以稳定的存在,但它在水溶液中不稳定,故C错误;D.高铁酸钾在碱性条件下生成,故D正确;故答案为:AD;
(2)固定其他条件,改变温度,看析出沉淀的快慢,则设计实验为取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢,具体操作为:将适量K2FeO4固体溶解水并等分为两份,置于不同温度的恒温水浴中,底部各放一张画有“+”字的白纸,观察记录看不到“+”字所需时间,故答案为:将适量K2FeO4固体溶解水并等分为两份,置于不同温度的恒温水浴中,底部各放一张画有“+”字的白纸,观察记录看不到“+”字所需时间;
(3)根据图示知道t1时刻前,硝酸根离子、氢离子浓度逐渐减小,亚铁离子浓度增大,则是金属铁和硝酸之间的反应,即4Fe+NO3-+10H+=4Fe2++NH4++3H2O; 故答案为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O。


科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
(ⅰ)I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(ⅱ)I2(s)+H2(g)![]() 2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是
A.1 mol I2(s)中通入2 g H2(g),反应吸热26.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
D.反应(ⅰ)放出的热量多,所以产物的能量低,比反应(ⅱ)的产物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
成分 | 质量(g) | 摩尔质量(g·mol-1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.075 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)配制一定物质的量浓度的上述“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、 、_____________、____________ 。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是 。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下MO3-与M-发生反应:MO3—+5M-+6H+=3M2 +3H2O,则下列关于M元素的叙述中正确的是
A. M位于元素期表的笫VA族
B. M的氢化物的水溶液呈酸性
C. MO3-中的M元素只能被还原
D. M2在常温常压下一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A. AgNO3 B. NaCl C. CuCl2 D. H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为配制240mL0.2mol·L-1Na2CO3溶液的示意图。回答下列问题:

(1)①中称得Na2CO3__________g。
(2)玻璃棒在②、③两步中的作用分别是____________、_____________。
(3)若出现如下情况,对所配溶液浓度有何影响?(填 “偏高”“偏低”或“无影响”)
A.某同学在第⑧步观察液面时时俯视___________;
B.没有进行操作步骤④和⑤ ___________;
C.在第⑤步不慎有少量液体流到容量瓶外_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag+ + 2NH3· H2O ![]() Ag(NH3)2 + 2H2O。下列分析不正确的是
Ag(NH3)2 + 2H2O。下列分析不正确的是
A.浊液中存在沉淀溶解平衡:AgCl (s) ![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
B.实验可以证明NH3结合Ag+能力比Cl-强
C.实验表明实验室可用氨水洗涤银镜反应后的试管
D.由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com