
【题目】食用白醋的有效成分为醋酸(CH3COOH),可使用酸碱中和滴定法进行测定。现用标准NaOH溶液测定市售“上海白醋”的总酸量(g/100mL)。请填写实验报告中的空白处。
(实验目的)测定市售“上海白醋”的总酸量
(实验用品)蒸馏水,上海白醋,0.1000mol/LNaOH标准溶液,酚酞;100mL容量瓶,___________,玻璃棒,滴定管,锥形瓶,烧杯,铁架台及附件。
(实验步骤)
(1)配制并移取待测食醋溶液:
①用___________(填仪器名称)量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得。
②取待测白醋溶液20.00 mL于锥形瓶中,并滴加2滴酚酞作指示剂。
(2)盛装标准NaOH溶液:滴定管经过洗涤后,装入NaOH标准溶液,使液面位于________________________________,记录滴定管的初读数。若液面位置如图所示,则此时的读数为____________mL。
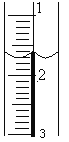
(3)滴定:当_____________________________________________时即为滴定终点。滴定到达终点后记录NaOH溶液的终点读数。再重复滴定3次。
(数据记录与处理)
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测食醋体积/mL | 20.00 | 20.00 | 20.00 | 20.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 15.95 | 16.20 | 15.15 | 16.20 |
(4)甲同学在处理数据时计算得:消耗NaOH溶液的平均体积(V)=![]() =15.76 mL,指出计算的不合理之处:____________________________________________,
=15.76 mL,指出计算的不合理之处:____________________________________________,
(5)按正确数据处理计算,“上海白醋”的总酸量=___________g/100mL。
(思考与讨论)
(6)查看瓶示:总酸≥5g/100mL(以醋酸计),则此次测量的相对误差至少为________。
(7)下列操作中可能造成该测量误差的是____________(填序号)。
a. 未用标准NaOH溶液润洗滴定管 b. 锥形瓶在滴定时剧烈摇动,有少量液体溅出
c. 滴定前未赶走滴定管尖嘴中的气泡 d. 锥形瓶中加入待测白醋溶液后,再加少量水
【答案】胶头滴管; 滴定管 “0”刻度或“0”刻度以下某处 1.60 溶液由无色变浅红,且保持半分钟不褪 第3次滴定误差明显,应舍去 4.800 -4%; b
【解析】
根据实验步骤确定所需实验仪器;
(1)①根据精确度要求,量取10.00mL食用白醋要用酸式滴定管;
(2)装入NaOH标准溶液,使液面位于“0”刻度或“0”刻度以下某处;根据滴管的刻度特点,上面的刻度小下面的刻度大,并要估读一位;
(3)溶液由酸性变成中性,根据指示剂颜色变化确定终点;
(4)根据数据的合理性来分析,
(5)根据白醋与NaOH 溶液反应的关系式:CH3COOH~NaOH来解答;
(6)误差=(实际值-理论值)/理论值;
(7)分析操作对消耗标准液体积的影响,根据C(待测)=C(标准)×V(标准)/V(待测)分析误差;
实验用品:定容时要用胶头滴管;
(1)①根据精确度要求,量取10.00mL食用白醋要用酸式滴定管;
(2)盛装标准NaOH溶液:滴定管经过洗涤后,装入NaOH标准溶液,使液面位于“0”刻度或“0”刻度以下某处,记录滴定管的初读数。若液面位置如图所示,则此时的读数为1.60mL。
(3)NaOH滴定食醋的终点为:溶液由无色恰好变为红色,并在半分钟内不褪色;
(4)第3次滴定误差明显,应舍去,3次消耗NaOH溶液的平均体积(V)=![]() =16.00 mL
=16.00 mL
(5)设20mL待测白醋中含有 CH3COOH 物质的量n,则
CH3COOH~NaOH
1 1
n 0.1000mol·L-1×0.016L
解得:n=0.0016mol,则10mL样品中含有醋酸物质的量为:0.0016mol×5=0.008mol,物质的量浓度为:0.008mol/0.01L=0.800mol·L-1,质量为:0.0080mol×60g·mol-1=0.48g,则100mL样品醋酸含有醋酸的质量为:4.8g,市售白醋总酸量=4.8g/100mL;
(6)误差=(实际值-理论值)/理论值=(4.8g-5.0g)÷5.0g×100%=-4.0%;
(7)a. 未用标准NaOH溶液润洗滴定管,导致消耗标准液体积偏大,则测定结果偏高,故不选;
b. 锥形瓶在滴定时剧烈摇动,有少量液体溅出,导致消耗标准液体积偏小,测定结果偏低,故选;
c. 滴定前未赶走滴定管尖嘴中的气泡,滴定后气泡消失,导致消耗标准液体积偏低,则测定结果偏高,故不选;
d. 锥形瓶中加入待测白醋溶液后,再加少量水,对消耗标准液体积不产生影响,测定结果无影响,故不选;
故选b。


科目:高中化学 来源: 题型:
【题目】某化学小组用50ml 0.50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体__ g。
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是______、______。
(3)他们记录的实验数据如下:
①请填写表中的空白:
实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 25.0℃ | 25.0℃ | 29.1 | Δt=________ |
2 | 25.0℃ | 25.0℃ | 29.8 | |
3 | 25.0℃ | 25.0℃ | 28.9 | |
4 | 25.0℃ | 25.0℃ | 29.0 | |
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________(用该实验的数据,取小数点后一位)。
(4)若用氨水代替NaOH做实验,测定结果ΔH会___(填“偏大”、“偏大”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及化合物与我们的生产、生活紧密相关。
(1)Fe3+的基态核外价电子排布式为_____,应用原子结构比较 Fe 与同周期的 Mn 第三电离能(I3)的大小:I3(Mn)______I3(Fe)(填>、<、=)。理由是______。
(2)Fe、Fe2+、Fe3+可以与 CO、SCN-、CN-、H2NCONH2(尿素)等多种配体形成很多的配合物。
①配合物 Fe(CO)5 的熔点-20℃,沸点 103℃,可用于制备纯铁。Fe(CO)5 的结构如图所示。下列关于 Fe(CO)5 说法不正确的是____。

A.Fe(CO)5 是分子晶体
B.Fe(CO)5 中 Fe 原子的配体与C22-互为等电子体
C.Fe(CO)5 中 σ 键与 π 键之比为 1:1
D.Fe(CO)5=Fe+5CO 反应中没有新化学键生成
②CN-的电子式为_____。
③H2NCONH2(尿素)中 N、C 原子的杂化方式分别为_____、______,组成尿素的 4 种元素的第一电离能由大到小的顺序为_____,1 mol H2NCONH2(尿素) 分子中含有 σ 键的数目为_____。
(3)NaCl 和MgO 都属于离子化合物,NaCl 的熔点为 801.3 ℃,MgO 的熔点高达 2800℃。造成两种晶体熔点差距的主要原因是_____。
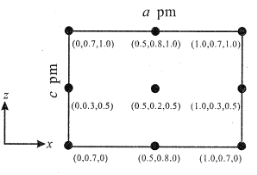
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7 属正交晶系(长方体形)。晶胞参数为 a pm、b pm、c pm。如图为沿 y 轴投影的晶胞中所有 Cs 原子的分布图和原子分数坐标。据此推断该晶胞中Cs 原子的数目为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由二氧化碳制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________________。
(2)反应Ⅲ能够自发进行的条件是_______________ (填“较低温度” “较高温度”或“任何温度” )。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是______。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。
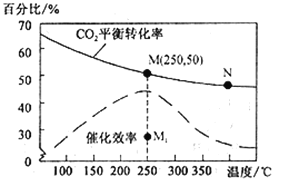
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M 点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知下列物质在20℃下的Ksp如下,试回答下列问题:
编号 | ① | ② | ③ | ④ | ⑤ |
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是(填编号)____________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时c(Br-)/c(Cl-)=________________。
③ 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是____。
A.KBr B.KI C.K2S D.K2CrO4
(6)已知25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成______________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中___________(填“还含有”或“不含有”)Al(OH)3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
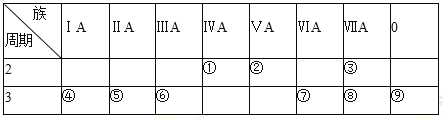
(1)①的元素符号为 _________;⑨的原子结构示意图为 _________。
(2)第3周期主族元素中,原子半径最小的是_________(用元素符号表示)。
(3)表中元素的气态氢化物中最稳定的是_____________________(用化学式表示)。
(4)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是_________(用化学式表示)。
(5)⑤、⑥两种元素相比较,金属性较强的是_________(填元素名称),可以验证这一结论的实验是_________(填正确选项的编号)。
A.将在空气中放置已久的这两种元素的块状单质分別放入NaOH溶液中,比较反应的剧烈程度
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,比较反应的剧烈程度
C.将形状,大小相同的这两种元素的单质分别和热水作用,并滴入酚酞试液,比较反应的剧烈程度
(6)④和⑥两种元素的最高价氧化物的水化物在水溶液中反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物分子结构简式如图所示,下列关于该物质的说法不正确的是( )
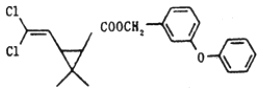
A.分子式为C21H20O3Cl2B.醚键上的氧原子至少与另外11个原子共面
C.该有机物最多与6molH2加成D.在一定条件下可发生加成、取代、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用酸性蚀刻废液(含![]() 等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
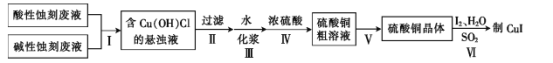
(1)步骤Ⅰ中发生了多个反应,其中![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为____。
与盐酸反应生成Cu(OH)Cl的离子方程式为____。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是____。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。
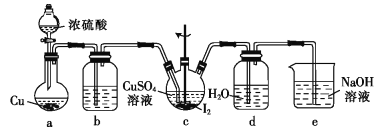
①装置a中盛装浓硫酸的仪器的名称是___,圆底烧瓶中发生反应的化学方程式为___。
②装置c中反应完成的现象是_____。
③用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式。
C6H12O6(葡萄糖)![]() 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某科研团队设计了一种新型能量存储/转化装置(如图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是( )

A.制氢时,溶液中K+向Pt电极移动
B.供电时,Zn电极附近溶液的pH不变
C.供电时,X电极发生还原反应
D.制氢时,X电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com