
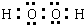 ��[Fe��C2O4��3]3-������������������������ӣ���������������ӣ�������������������
��[Fe��C2O4��3]3-������������������������ӣ���������������ӣ����������������������� ��1��H2O2Ϊ���ۻ����[Fe��C2O4��3]3-Ϊ�����ӣ�
��2������ԭ���غ�����ƽ��ѧ��Ӧ����ʽ��
��3�����ᱻH2O2��������ˮ�Ͷ�����̼��
��4��K3[Fe��C2O4��3]•3H2O�е���Ϊ�������ӣ�����������KSCN��Һ��ΪѪ��ɫ��
��5��A��KCN+Fe3C+C+N2��n��N2��=0.1mol��n��Fe3C��=0.1mol��$\frac{1}{3}$��n��C��=$\frac{0.1mol��\frac{1}{3}��180g/mol��\frac{1}{3}}{12g/mol}$=$\frac{1}{6}$mol��n��KCN��=$\frac{36.8g-0.1mol��28g/mol-6g-2g}{65g/mol}$=0.4mol��ȷ��ԭ�Ӹ����ȵó���ѧʽ��
��� �⣺��1��H2O2Ϊ���ۻ���������ʽΪ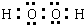 ��[Fe��C2O4��3]3-Ϊ�����ӣ�����Ϊ����������������ӣ���������������ӣ��������������������ʴ�Ϊ��
��[Fe��C2O4��3]3-Ϊ�����ӣ�����Ϊ����������������ӣ���������������ӣ��������������������ʴ�Ϊ��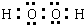 ��[Fe��C2O4��3]3-Ϊ�����ӣ�����Ϊ����������������ӣ���������������ӣ�������������������
��[Fe��C2O4��3]3-Ϊ�����ӣ�����Ϊ����������������ӣ���������������ӣ�������������������
��2������ˮ�ĸ�������С������Ϊ6����FeC2O4•2H2O�Ļ�ѧ������Ϊ2��K3[Fe��C2O4��3]•3H2O�Ļ�ѧ������Ϊ3��Ȼ����ԭ���غ��֪���û�ѧ��ӦΪ2FeC2O4•2H2O+H2O2+3K2C2O4+H2C2O4=2K3[Fe��C2O4��3]•3H2O���ʴ�Ϊ��2��1��3��1��2��
��3�����ᱻH2O2��������ˮ�Ͷ�����̼���÷�ӦΪH2C2O4+H2O2=2CO2��+2H2O���ʴ�Ϊ��H2C2O4+H2O2=2CO2��+2H2O��
��4��K3[Fe��C2O4��3]•3H2O�е���Ϊ�������ӣ�������KSCN��Һ����K3[Fe��C2O4��3]•3H2O�е���Ԫ�أ�������Ԫ�صķ���Ϊȡ����������ȣ�ȡ����������ܽ���H2SO4�У�ȡ�ϲ���Һ���Թ��У��μ�KSCN��Һ������Һ��Ѫ��ɫ������Ԫ�أ���֮���ޣ�
�ʴ�Ϊ����ȡ����������ȣ�ȡ����������ܽ���H2SO4�У�ȡ�ϲ���Һ���Թ��У��μ�KSCN��Һ������Һ��Ѫ��ɫ������Ԫ�أ���֮���ޣ�
��5���������֪��A��KCN+Fe3C+C+N2��n��N2��=0.1mol��n��Fe3C��=0.1mol��$\frac{1}{3}$��n��C��=$\frac{0.1mol��\frac{1}{3}��180g/mol��\frac{1}{3}}{12g/mol}$=$\frac{1}{6}$mol��n��KCN��=$\frac{36.8g-0.1mol��28g/mol-6g-2g}{65g/mol}$=0.4mol����K��Fe��C��N��ԭ�Ӹ�����Ϊ4��1��6��6����ѧʽΪK4Fe��CN��6���ʴ�Ϊ��K4Fe��CN��6��
���� ���⿼��֪ʶ��϶࣬�漰����ʽ����Ӧ����ƽ��������ԭ��Ӧ�����ӵļ��鼰��ѧʽ��ȷ������5����ע�������غ��������Ŀ�Ѷ��еȣ�


 ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д� �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д� ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol���������ԼΪ22.4L | |
| B�� | ��״���£�1molˮ�����ԼΪ22.4L | |
| C�� | 1mol�κ����壬ֻ���ڱ�״���������ԼΪ22.4L | |
| D�� | ͬ��ͬѹ�£���ͬ�����������������ʵ���һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼-12��ԭ�ӷ��ţ�12 6C | |
| B�� | ��������ӵĽṹʽ��H-O-Cl | |
| C�� | �����ӵĵ����Ų�ʽΪ��1s22s22p63s23p6 | |
| D�� | ��������ķ���ʽ��SiO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��֪A��B��C��D��E��F����Ԫ�����ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵�������ε�����Bԭ�ӵ�P�����������γ��⻯��ķе���ͬ����Ԫ�ص��⻯������͵ģ�Dԭ�ӵõ�һ�����Ӻ�3P���ȫ������A+��Dԭ���γɵ�������һ�����Ӳ㣮C��A�γ�A2C�����ӻ����E��ԭ������Ϊ31��F��B��ͬһ���壬E��F�γɵĻ����ﳣ��������뵼�壮����������Ϣ���ش��������⣺
��֪A��B��C��D��E��F����Ԫ�����ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵�������ε�����Bԭ�ӵ�P�����������γ��⻯��ķе���ͬ����Ԫ�ص��⻯������͵ģ�Dԭ�ӵõ�һ�����Ӻ�3P���ȫ������A+��Dԭ���γɵ�������һ�����Ӳ㣮C��A�γ�A2C�����ӻ����E��ԭ������Ϊ31��F��B��ͬһ���壬E��F�γɵĻ����ﳣ��������뵼�壮����������Ϣ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
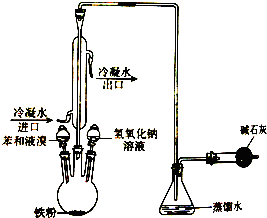 ��ͼ��ʵ������ȡ�屽��װ��ͼ����ش��������⣺
��ͼ��ʵ������ȡ�屽��װ��ͼ����ش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� |
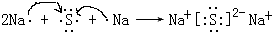 ���û������������ӻ��������ۡ������ӡ�����
���û������������ӻ��������ۡ������ӡ�����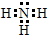 ���û����ﺬ�Ļ�ѧ�������ǹ��ۼ���
���û����ﺬ�Ļ�ѧ�������ǹ��ۼ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �� CH3CH2OH��l��+3O2��g���T2CO2��g��+3H2O��g����H=-1366.8 kJ•mol-1����֪�Ҵ��ı�ȼ����Ϊ1366.8 kJ•mol-1 | |
| B�� | ��֪��C�����ʯ��s��=C��ʯī��s����H��0������ʯ��ʯī�ȶ� | |
| C�� | ��֪��N2��g��+O2��g���T2NO��g����H=+180 kJ•mol-1 2CO��g��+O2��g���T2CO2 ��g����H=-566 kJ•mol-1 �� 2CO��g��+2NO��g���TN2 ��g��+2CO2��g����H=-746 kJ•mol-1 | |
| D�� | OH-��aq��+H+��aq���TH2O��l����H=-57.3 kJ•mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com