
| A. | 5.4KJ | B. | 350KJ | C. | 3.5KJ | D. | 8.5KJ |
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
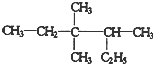 3,3,4-三甲基已烷
3,3,4-三甲基已烷 、
、 .
. ,则其分子式为C10H16,该烃的一溴取代物有2种.
,则其分子式为C10H16,该烃的一溴取代物有2种. .
.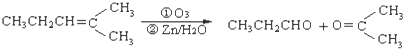 上述反应可用来推断烃分子中碳碳双键的位置.某烃A的分子式为C6H10,经过上述转化生成
上述反应可用来推断烃分子中碳碳双键的位置.某烃A的分子式为C6H10,经过上述转化生成 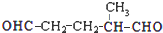 ,则烃A的结构可表示为
,则烃A的结构可表示为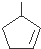 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:
W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、Al2Cl6 | B. | CO2、SO42- | ||
| C. | PCl5、[Co(NH3)4Cl2]Cl | D. | NH4Cl、[Cu(NH3)4]SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先与Cl2加成,再与Br2加成 | B. | 先与Cl2加成,再与HBr加成 | ||
| C. | 先与HCl加成,再与Br2加成 | D. | 先与HCl加成,再与HBr加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硫酸和浓硝酸都能用来直接跟锌粒反应制氢气 | |
| B. | 浓硫酸和浓硝酸都能与单质碳反应 | |
| C. | 浓硫酸和浓硝酸加水稀释后都能与金属铜反应 | |
| D. | 浓硫酸和浓硝酸在常温下都能用金属铝制容器盛放 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com