
下述实验设计能够达到目的的是
编号 | 实验目的 | 实验设计 |
A. | 除去CO2中少量的SO2 | 将混合气体通过饱和Na2CO3溶液 |
B. | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸 |
C. | 检验溶液中是否含有Fe2+ | 向溶液中滴人氯水水后,再滴加KSCN 溶液 |
D. | 证明H2CO3酸性比H2SiO3强 | 将CO2通人Na2SiO3溶液中 |
D
【解析】
试题分析:A.将混合气体通过饱和Na2CO3溶液, CO2、SO2都发生反应,不能达到除杂的目的,错误;B.Cu、CuO都能与稀硝酸发生反应,因此不能达到除杂的目的,错误;C.若向溶液中滴入氯水,溶液中的Fe2+会被氧化为Fe3+,因此再滴加KSCN 溶液,溶液变为红色,可能是Fe2+会被氧化为Fe3+,也可能是原溶液就含有Fe3+,不能检验离子的存在,错误;D. 将CO2通入Na2SiO3溶液中,会发生反应:CO2+H2O+Na2SiO3= H2SiO3↓+ Na2CO3,可以证明酸性H2CO3> H2SiO3,正确。
考点:考查化学实验方案的设计的正误判断的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年湖南省益阳市高二上学期期中化学(文)试卷(解析版) 题型:选择题
分类是学习和研究化学的一种重要方法,下列分类合理的是
A.NaHCO3和Na2O都属于钠盐
B.K2O和Na2SiO3都属于氧化物
C.KOH和Na2CO3都属于强碱
D.H2SO4和HNO3都属于酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是

A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
现有等物质的量组成的Fe、Cu合金共0.1 mol,研成粉末后,全部投入稀硝酸中,微热使其充分反应,已知硝酸的还原产物只有NO。由于HNO3用量的不同,溶液中的金属离子和残留固体的成分会有多种情况。下列说法正确的是
A.根据溶液中的金属离子和残留固体的成分最多会有5种情况
B.若金属有剩余,在溶液中再滴入稀硫酸后,金属不会溶解
C.当合金刚好溶解时,在标准状况下产生2.24LNO
D.若合金全部溶解,在溶液中加入过量的氨水,(已知铜离子可转化为四氨合铜络离子溶于水)则经过滤、洗涤、干燥、充分灼烧、称量可得固体4g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。下列关于该反应的说法正确的是
A.CuSO4发生了氧化反应
B.氧化产物和还原产物的物质的量之比为5:6
C.白磷只作还原剂
D.该反应中被硫酸铜氧化的白磷有3mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.铁在空气中燃烧可生成氧化铁,镁在空气中燃烧可生成氧化镁、氮化镁
B.分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间
C.红宝石、蓝宝石的主要成分是氧化铝,而石英玻璃、分子筛的主要成分是硅酸盐
D.针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:填空题
(14分)过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
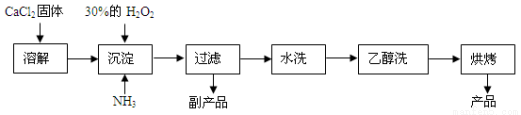
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________;
(2)检验“水洗”是否合格的方法是________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①____________;②____________。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知: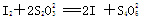 】
】
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是_________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
化学在人类生活中扮演着重要角色,以下应用正确的是
A.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
B.日常生活中无水乙醇常用于杀菌消毒
C.使用无磷洗衣粉,可彻底解决水体富营养化问题
D.天然药物无任何毒副作用,可长期服用
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:填空题
(11分)应用化学学科知识,回答下列问题
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) △H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) △H = -566.0 kJ/mol
H2O(g)=H2O(1) △H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ________。
(2)水煤气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
(3)已知A和B在一定条件下可建立如下平衡:2A(g)+B(g) 2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
①达到平衡所需时间是Ⅰ Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中C的体积分数关系是Ⅰ Ⅱ。
②平衡时,测得容器Ⅱ中的压强减小了30%,则该容器中A的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com